2022-2023學年吉林省長春市部分高中高二(上)月考化學試卷(10月份)
發布:2025/1/2 10:30:4
一、單項選擇題(本大題包括19小題,每小題3分,請將正確選項填涂在答題卡上)
-
1.C(金剛石)=C(石墨)△H=-1.9kJ/mol,下列說法正確的是( )
A.金剛石變成石墨是物理變化 B.金剛石比石墨穩定 C.12g金剛石所具有的能量比12g石墨低 D.二者能量不同的原因可能是其中的化學鍵不同 組卷:5引用:1難度:0.7 -
2.下列依據熱化學方程式得出的結論正確的是( )
A..已知:N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1,則在密閉容器中,過量的N2與1.5molH2反應時放出46.2kJ的能量 B.已知H+(aq)+OH-(aq)═H2O(l),生成1molH2O(l)放出熱量57.3kJ,NaOH的稀溶液與稀醋酸反應生成1molH2O時,放出57.3kJ的熱量 C.12g石墨轉化為CO(g)時,放出110.5kJ的熱量2C(石墨,s)+O2(g)═2CO(g)ΔH=-110.5kJ?mol-1 D.CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的ΔH=+566.0kJ?mol-1 組卷:14引用:1難度:0.7 -
3.下列各組熱化學方程式中,化學反應的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g)△H1 C(s)+O2(g)═CO(g)△H212
②S(s)+O2(g)═SO2(g)△H3 S(g)+O2(g)═SO2(g)△H4
③H2(g)+O2(g)═H2O(l)△H5 2H2(g)+O2(g)═2H2O(l)△H612
④CaCO3(s)═CaO(s)+CO2(g)△H7 CaO(s)+H2O(l)═Ca(OH)2(s)△H8.A.① B.④ C.②③④ D.①②③ 組卷:811引用:181難度:0.7 -
 4.實現“節能減排”和“低碳經濟”的一項重要課題就是如何將CO2轉化為可利用的資源。目前工業上用CO2來生產燃料甲醇的一種反應是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如圖表示該反應過程中能量(單位為kJ?mol-1)的變化。下列說法中正確的是( )
4.實現“節能減排”和“低碳經濟”的一項重要課題就是如何將CO2轉化為可利用的資源。目前工業上用CO2來生產燃料甲醇的一種反應是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如圖表示該反應過程中能量(單位為kJ?mol-1)的變化。下列說法中正確的是( )A.該反應的△H<0,△S<0,該反應在任何溫度下都能自發進行 B.該反應的△H>0,△S>0,該反應在高溫時能自發進行 C.該反應的△H<0,△S<0,該反應在低溫時能自發進行 D.該反應的△H<0,△S>0,該反應在任何溫度下都不能自發進行 組卷:34引用:3難度:0.6 -
5.對于可逆反應N2(g)+3H2(g)?2NH3(g),下列措施能使反應物中活化分子百分數和化學平衡常數都變化的是( )
A.增大壓強 B.充入更多N2 C.使用高效催化劑 D.降低溫度 組卷:226引用:17難度:0.9 -
6.如圖所示的各圖中,表示2A(g)+B(g)?2C(g)(ΔH<0)這個可逆反應的正確圖象為(注:Φ(C)表示C的體積分數,P表示氣體壓強,C表示濃度)( )
A. 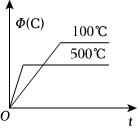
B. 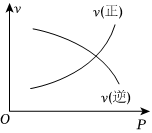
C. 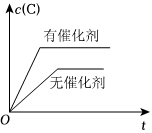
D. 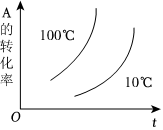 組卷:60引用:6難度:0.5
組卷:60引用:6難度:0.5 -
7.在一定溫度下的恒容密閉容器中,當下列物理量不再發生變化時,表明反應A(s)+3B(g)?2C(g)+D(g)已達平衡狀態的是( )
①混合氣體的壓強 ②混合氣體的密度 ③B的物質的量濃度 ④氣體的總物質的量 ⑤混合氣體的平均相對分子質量.A.①②③ B.②③⑤ C.①③⑤ D.①④⑤ 組卷:70引用:10難度:0.9
二、填空題
-
 22.合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:N2(g)+3H2(g)?2NH3(g)ΔH=-92kJ/mol;據此回答以下問題:
22.合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:N2(g)+3H2(g)?2NH3(g)ΔH=-92kJ/mol;據此回答以下問題:
(1)根據溫度對化學平衡的影響規律可知,對于該反應溫度越高,其化學平衡常數的值。(填“越大”、“越小”或“不變”)
(2)某溫度下,若把10molN2與30molH2置于體積為10L的密閉容器內,反應達到平衡狀態時,測得混合氣體的壓強變為開始時的,則平衡時氫氣的轉化率α=910(用百分數表示)。能說明該反應達到化學平衡狀態的是(填字母)。
a.容器內的密度保持不變
b.容器內壓強保持不變
c.v正(N2)=2v逆(NH3)
d.混合氣體中c(NH3)不變
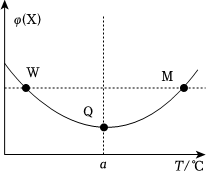
(3)某2L恒容密閉容器中充入2molX(g)和1molY(g)發生反應:2X(g)+Y(g)?3Z(g)ΔH,反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如圖所示,ΔH0。組卷:34引用:1難度:0.6 -
23.Ⅰ.一定條件下,在容積為5L的密閉容器中,A、B、C三種氣體的物質的量n隨時間t的變化如圖甲所示。已知達到平衡后,降低溫度,A的體積分數減小。
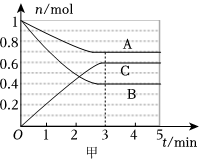
(1)該反應的化學方程式為。
(2)該反應的反應速率v隨時間t的關系如圖乙所示。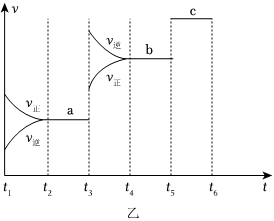
①根據圖乙判斷,在t3時刻改變的外界條件是。
②a、b、c對應的平衡狀態中,C的體積分數最大的是狀態。
③各階段的平衡常數如下表所示:
K1、K2、K3之間的大小關系為t2~t3 t4~t5 t5~t6 K1 K2 K3 (用“>”“<”或“=”連接)。
Ⅱ.在密閉容器中充入一定量的H2S,發生反應:2H2S(g)?2H2(g)+S2(g)ΔH,如圖丙所示為H2S氣體分解生成H2(g)和S2(g)的平衡轉化率與溫度、壓強的關系。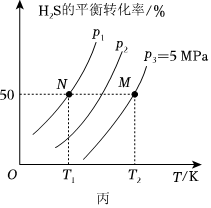
(3)ΔH(填“>”“<”或“=”)0。
(4)圖丙中壓強(p1、p2、p3)由大到小的順序為。
(5)圖丙中M點對應的平衡常數Kp=MPa(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。組卷:136引用:2難度:0.5


