2009年江蘇省“化學與可持續發展”活動周競賽初賽試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括15個小題,第小題2分,共30分.每小題有1個或2個選項符合題意.若有兩個答案的錯選1個不得分,漏選1個扣1分.請將答案填在下方的表格內)
-
1.三聚氰胺(化學式為C3H6N6),是一種化工原料.它是白色晶體,幾乎無味,有毒性,可導致人體泌尿系統產生結石,不可用于食品加工或食品添加物.下列有關三聚氰胺的說法錯誤的是( )
A.三聚氰胺屬于化合物 B.三聚氰胺的相對分子質量是126 C.1個三聚氰胺分子由3個碳原子、6個氫原子和6個氮原子構成 D.三聚氰胺中碳元素與氫元素的質量比為1:2 組卷:14引用:6難度:0.7 -
2.下列日常生活中的做法可行的是( )
①大豆、花生和谷物被霉菌污染后,人不可食用,但可喂養家禽
②由于淀粉有遇碘變藍的特性,可利用淀粉檢驗加碘食鹽的真假
③喝牛奶、豆漿等富含蛋白質的食品可有效緩解重金屬鹽中毒現象
④低血糖病癥發作時,吃饅頭要比喝葡萄糖水見效快
⑤患有夜盲癥的病人,多食用動物肝臟有利于視力恢復.A.①③④ B.②④ C.②③⑤ D.③⑤ 組卷:81引用:26難度:0.9 -
3.下面是某學生學習化學用語后一次練習的部分內容,其中不正確的是( )
A.2MnO42-:表示兩個高錳酸根離子 B.2Ar:表示2個氬分子或2個氬原子 C.Fe2+:表示1個亞鐵離子 D.H2S中的“2”表示一個硫化氫分子中含有2個氫原子 組卷:40引用:13難度:0.9 -
4.下列實驗操作,能達到預期目的是( )
①用托盤天平稱取5.6g CuO粉末
②用10mL水和10mL酒精配制成20mL酒精溶液
③將50g溶質質量分數為10%的稀鹽酸加熱蒸發掉25g水,得到溶質質量分數為20%的鹽酸
④用10mL量筒量取8.2mL水。A.①④ B.①②④ C.①③④ D.②③ 組卷:135引用:30難度:0.9 -
5.有下列四種實驗設計及操作,實驗過程中其現象不足以說明CO2與NaOH溶液發生了反應的是( )
A. 
B. 
C. 
D.  組卷:591引用:64難度:0.9
組卷:591引用:64難度:0.9 -
6.某工廠常用1體積的濃硫酸(密度為1.84g/cm3,溶質的質量分數為98%)和7體積蒸餾水混合來配制體積比濃度為1:7的稀硫酸,該稀硫酸中溶質的質量分數最接近于( )
A.10% B.15% C.20% D.25% 組卷:68引用:8難度:0.7 -
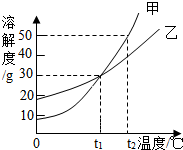 7.甲、乙兩物質的溶解度曲線如圖所示,下列敘述中正確的是( )
7.甲、乙兩物質的溶解度曲線如圖所示,下列敘述中正確的是( )A.t1℃時,甲和乙的溶解度均為30 B.t2℃時,甲和乙的飽和溶液中溶質的質量分數相等 C.t2℃時,在100g水中放入60g甲,其溶質的質量分數為37.5% D.t2℃時,分別在100g水中各溶解20g甲、乙,同時降低溫度,甲先達到飽和 組卷:125引用:57難度:0.7 -
8.有一小包質量為ag的NaHCO3和Ca(HCO3)2的固體混合物,小明將該包固體充分加熱(僅發生反應:①Ca(HCO3)2
CaCO3+CO2↑+H2O ②2NaHCO3△Na2CO3+CO2↑+H2O ),將生成的CO2全部通入足量的石灰水中產生bg CaCO3沉淀;芳芳在小明加熱、冷卻后的試管中又加入足量的稀鹽酸,再將生成的氣體全部通入足量的石灰水,結果產生cg CaCO3沉淀.那么下列關系一定正確的是( )△A.a=c B.a<b+c C.b<c D.a<b 組卷:241引用:7難度:0.5 -
9.有反應:X+H2SO4=BaSO4+2Y,下面分析正確的是( )
A.Y中一定含有氫元素 B.X一定是BaCl2 C.Y可能是HCl D.X和Y的相對分子質量之差為l35 組卷:170引用:7難度:0.7 -
10.下列曲線圖與實驗事實相一致的是( )
A. 
向一定體積HCl溶液中滴加NaOH溶液B. 
恒溫時向一定量飽和NaCl溶液中不斷加入蔗糖C. 
向一定量的HCl和CaCl2混合液中不斷滴入Na2CO3溶液D. 
向CuCl2和H2SO4的混合液中加入過量的Ba(OH)2溶液組卷:197引用:18難度:0.9
四、計算題(本題共2小題,共10分)
-
29.實驗室中濃鹽酸的商標如表所示.欲配制730g溶質質量分數為10%的稀鹽酸,請根據有關信息計算,需這種濃鹽酸多少g?體積為多少?
鹽酸
化學純試劑
500mL約500g
化學式HCl
相對分子質量:36.46
密度1.18g/mL
質量分數為36.5%組卷:37引用:2難度:0.5 -
30.航天技術中的火箭推進劑可用醇類為燃料,液態氧為氧化劑,但后者的沸點較低(-183℃),需要額外的隔熱裝置,因而增加了火箭的重量.為了避免此缺點,可用過氧化氫(H2O2)代替液態氧,它具有相對高的沸點和較低的凝固點,而且沒有毒性,和醇反應時也能放出很高的能量.現有一液體推進劑以醇(含碳52%、含氫13%、含氧35%)為燃料,質量分數為90%的過氧化氫做氧化劑,欲使1kg該醇燃料完全燃燒,計算需消耗質量分數為90%的過氧化氫的質量(提示:可按2H2O2=2H2O+O2↑得到的氧氣與醇反應來計算).
組卷:112引用:10難度:0.1


