2021-2022學年四川省成都市簡陽市陽安中學高二(上)月考化學試卷(12月份)
發布:2024/4/20 14:35:0
一、單選題(每題2分,共44分)
-
1.下列離子方程式書寫正確的是( )
A.HCO3-在水溶液中的電離方程式:HCO3-+H2O?H3O++CO32- B.H2SO3的電離方程式:H2SO3?2H++SO32- C.CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- D.CuSO4的水解方程式:Cu2++2H2O═Cu(OH)2↓+2H+ 組卷:21引用:1難度:0.7 -
2.NaOH標準溶液的配制和標定,需經過NaOH溶液配制、基準物質H2C2O4?2H2O的稱量以及用NaOH溶液滴定等操作。下列有關說法正確的是( )
A. 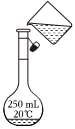
用圖所示操作轉移NaOH溶液到容量瓶中B. 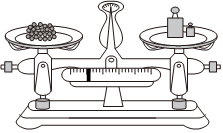
用圖所示裝置準確稱得0.1575gH2C2O4?2H2O固體C. 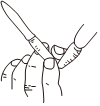 用
用
圖所示操作排除堿式滴定管中的氣泡D. 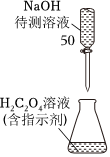
用圖所示裝置以NaOH待測液滴定H2C2O4溶液組卷:74引用:19難度:0.9 -
3.下列說法正確的是( )
A.在常溫下,放熱反應一般能自發進行,吸熱反應都不能自發進行 B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ?mol-1,能自發進行,原因是體系有自發地向混亂度增加的方向轉變的傾向 C.因為焓變和熵變都與反應的自發性有關,因此焓變或熵變均可以單獨作為反應自發性的判據 D.在其他外界條件不變的情況下,使用催化劑,可以改變化學反應進行的方向 組卷:592引用:31難度:0.9 -
4.為除去MgCl2溶液中的FeCl3,可在加熱攪拌的條件下加入的一種試劑是( )
A.NaOH B.Na2CO3 C.氨水 D.MgO 組卷:66引用:19難度:0.7 -
5.把FeCl3溶液蒸干灼燒,最后得到的固體產物是( )
A.無水 FeCl3 B.Fe(OH)3 C.FeO D.Fe2O3 組卷:26引用:7難度:0.9 -
6.兩份2molH2分別與足量的O2充分反應,生成液態水時放出的熱量為571.6kJ、生成水蒸氣的反應熱為ΔH2。下列說法正確的是( )
A.ΔH2>-571.6kJ/mol B.用熱化學方程式表示氫氣的燃燒熱為:2H2(g)+O2(g)═2H2O (l) ΔH1=-571.6kJ/mol C.2molH2(g)和1molO2(g)所具有的總能量低于2mol H2O (l)具有的能量 D.反應2H2(g)+O2(g)═2H2O (l)的ΔH<0,ΔS>0 組卷:11引用:2難度:0.5 -
7.工業合成氨的熱化學方程式可寫成:N2(g)+3H2(g)?2NH3(g) ΔH1,此時反應的化學平衡常數為K1;相同條件下合成氨的熱化學方程式還可寫成:
N2(g)+12H2(g)?NH3(g) ΔH2,此時反應的化學平衡常數為K2。則下列說法正確的是( )32A.K1=2K2 B.K1=K22 C.ΔH1=ΔH 2 D.ΔH1=ΔH22 組卷:57引用:2難度:0.7 -
8.常溫下下列溶液中各組離下一定能大量共存的是( )
A.由水電離產生的c(H+)=1.0×10-12mol/L的溶液:K+、SO42-、CO32-、Cl- B. =0.1mol/的溶液:Na+、K+、CO32-、NO3-Kwc(H+)C.甲基橙變紅的溶液中:Na+、K+、Cl-、S2O32- D.含有S2-的溶液:Al3+、H+、MnO4-、SO42- 組卷:23引用:1難度:0.7
二、填空題
-
25.硫是一種很活潑的元素,在適宜的條件下能形成-2、+6、+4、+2價的化合物。
Ⅰ.焦亞硫酸鈉(Na2S2O5)是常用的食品抗氧化劑之一,帶有強烈的SO2氣味,久置于空氣中易被氧化,其溶于水生成的NaHSO3溶液呈酸性。某研究小組采用如圖所示裝置(實驗前已除盡裝置內的空氣)制取Na2S2O5
。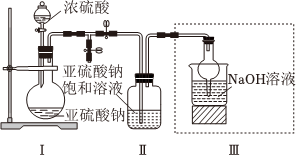
(1)裝置Ⅰ中的濃硫酸(填“能”或“不能”)用稀硫酸代替,原因是。
(2)裝置Ⅱ中有Na2S2O5晶體析出,要獲得已析出的晶體,可采取的操作是。
(3)設計檢驗Na2S2O5晶體在空氣中變質的實驗方案:。
Ⅱ.Na2S2O3溶液可用于測定溶液中ClO2的含量,實驗方案如下。
步驟1:準確量取ClO2溶液10.00mL,稀釋至100mL。
步驟2:量取V1mL稀釋后的ClO2溶液于錐形瓶中,調節溶液的pH≤2,加入足量的KI晶體,搖勻,在暗處靜置30分鐘。(已知:ClO2+I-+H+→I2+Cl-+H2O未配平)
步驟3:以淀粉溶液作指示劑,用cmol?L-1Na2S2O3溶液滴定至終點,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-═2I-+S4O62-)
(1)準確量取10.00mLClO2溶液的玻璃儀器是。
(2)確定滴定終點的現象為。
(3)根據上述步驟計算出原ClO2溶液的物質的量濃度為mol?L-1(用含字母的代數式表示)。
(4)下列操作會導致測定結果偏高的是(填字母)。
A.未用標準濃度的Na2S2O3溶液潤洗滴定管
B.滴定前錐形瓶中有少量水
C.滴定前滴定管尖嘴部分有氣泡,滴定后氣泡消失
D.讀數時,滴定前仰視,滴定后俯視組卷:11引用:1難度:0.6 -
26.硫酸鐵銨[NH4Fe(SO4)2?xH2O]是一種重要鐵鹽。為充分利用資源,變廢為寶,在實驗室中探究采用廢鐵屑來制備硫酸鐵銨,具體流程如圖:
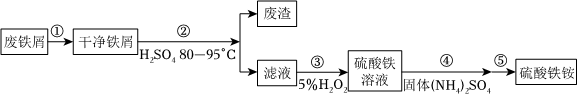
回答下列問題:
(1)步驟①的目的是去除廢鐵屑表面的油污,方法是。
(2)步驟②需要加熱的目的是,溫度保持80-95℃,采用的合適加熱方式是。鐵屑中含有少量硫化物,反應產生的氣體需要凈化處理,合適的裝置為(填標號)。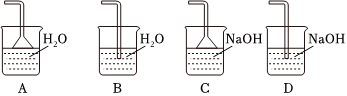
(3)步驟③中選用足量的H2O2,理由是。分批加入H2O2,同時為了,溶液要保持pH小于0.5。
(4)步驟⑤的具體實驗操作有,經干燥得到硫酸鐵銨晶體樣品。
(5)采用熱重分析法測定硫酸鐵銨晶體樣品所含結晶水數,將樣品加熱到150℃時失掉1.5個結晶水,失重5.6%.硫酸鐵銨晶體的化學式為。組卷:2077引用:14難度:0.4


