2016-2017學年江西省贛州市于都二中高三(上)第三次周考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共12小題,每小題5分,滿分60分)
-
1.下列說法正確的是( )
A.用苯萃取溴水中的溴時,將溴的苯溶液從分液漏斗下口倒出 B.使用容量瓶的第一步操作是先將容量瓶用蒸餾水洗滌后烘干 C.檢驗某溶液是否含有 時,應取少量該溶液,依次加入BaCl2溶液和稀鹽酸SO2-4D.用10mL量筒量取9.2mL NaCl溶液 組卷:5引用:5難度:0.7 -
2.兩份質量相同的CH4和NH3比較,下列結論錯誤的是( )
A.分子個數比為17:16 B.原子個數比為17:16 C.氫原子個數比為17:12 D.氫原子質量比為17:12 組卷:276引用:34難度:0.9 -
3.設NA 表示阿伏加德羅常數的值.下列說法正確的是( )
A.標準狀況下,0.1 mol Cl2 溶于水,轉移的電子數目為0.1NA B.常溫常壓下,18 g H2O 中含有的原子總數為3NA C.標準狀況下,11.2 L CH3CH2OH 中含有的分子數目為0.5NA D.常溫常壓下,2.24 L CO 和CO2 混合氣體中含有的碳原子數目為0.1NA 組卷:912引用:15難度:0.7 -
4.下列溶液中,溶質的物質的量濃度不是1mol?L-1的是( )
A.10 g NaOH固體溶解在水中配成250 mL溶液 B.將80 g SO3溶于水并配成1 L的溶液 C.將0.5 mol?L-1的NaNO3溶液100 mL加熱蒸發掉50 g水的溶液 D.標況下,將22.4 L氯化氫氣體溶于水配成1 L溶液 組卷:139引用:12難度:0.7
二、解答題(共2小題,滿分40分)
-
13.FeCl3是一種很重要的鐵鹽,主要用于污水處理,具有效果好、價格便宜等優點。工業上可將鐵屑溶于鹽酸中,先生成FeCl2,再通入Cl2氧化來制備FeCl3溶液。
(1)將標準狀況下的aL氯化氫氣體溶于100g水中,得到的鹽酸的密度為bg?mL-1,則該鹽酸的物質的量的濃度是;
(2)向100mL的FeBr2溶液中通入標準狀況下Cl23.36L,反應后的溶液中Cl-和Br-的物質的量濃度相等,則原FeBr2溶液的物質的量濃度為;
(3)FeCl3溶液可以用來凈水,其凈水的原理為Fe3++3H2O?Fe(OH)3(膠體)+3H+(用離子方程式表示),若用100mL 2mol?L-1的FeCl3溶液凈水時,生成具有凈水作用的微粒數小于0.2NA(填“大于”、“等于”或“小于”)。組卷:9引用:3難度:0.4 -
14.下面是4 種鹽在不同溫度下的溶解度(g/100g H2O):
(假設:①鹽類共存時,不影響各自的溶解度;②分離晶體時,溶劑的損耗忽略不計)溫度 NaNO3 KNO3 NaCl KCl 10℃ 80.5 20.9 35.7 31.0 100℃ 175 246 39.1 56.6
某同學設計用物質的量之比為1:1的硝酸鈉和氯化鉀為原料,加入一定量的水制取硝酸鉀的實驗,其實驗流程如圖所示: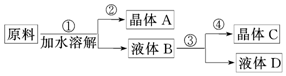
(1)在①和③的實驗過程中,關鍵的實驗條件是。
(2)分離出晶體②和④的操作是(填“傾倒”、“蒸發”、“結晶”或“過濾”)。硝酸鉀是晶體(填“A”或“C”)。
(3)粗產品中可能含有的雜質離子是檢驗其中陰離子的方法是。
(4)欲將粗產品提純,可采取的方法是。組卷:26引用:1難度:0.6


