2010-2011學年江蘇省南京市浦口區江浦高中高三(上)模塊化學試卷(11月份)
發布:2024/10/29 8:30:3
一、單選題(本題共7小題,每題2分,共14分.每題只有一個正確答案.)
-
1.出土的錫青銅(銅錫合金)文物常有Cu2(OH)3Cl覆蓋在其表面.下列說法正確的是( )
A.錫青銅的熔點比純銅高 B.在自然環境中,錫青銅中的錫對銅起保護作用 C.錫青銅文物在潮濕環境中的腐蝕比干燥環境中慢 D.生成Cu2(OH)3Cl覆蓋物是電化學腐蝕過程,但不是化學反應過程 組卷:37引用:6難度:0.7 -
2.下列敘述正確的是( )
A.鑒別兩種無色溶液Na2CO3與NaHCO3可以用石灰水 B.Mg和Cu的冶煉方法一定要用相同方法:熱還原法 C.SO2與CO2對環境污染的原理:均形成酸雨 D.Na2SiO3與Na2O?SiO2是同種物質:都是硅酸鹽 組卷:13引用:2難度:0.7 -
3.類推的思維方法在化學學習與研究中常會產生錯誤的結論,因此類推的結論最終要經過實踐的檢驗才能確定其正確與否.下列幾種類推結論中,正確的是( )
A.由2Cu+O2═2CuO可推出同族的硫也有Cu+S═CuS B.Fe3O4可表示為FeO?Fe2O3,則Pb3O4可表示為PbO?Pb2O3 C.Mg能在CO2中燃燒,所以Na也能在CO2中燃燒 D.CO2與Na2O2反應只生成Na2CO3和O2,故SO2與Na2O2反應只生成Na2SO3和O2 組卷:22引用:3難度:0.9 -
4.某溶液既能溶解Al(OH)3又能溶解H2SiO3,在該溶液中可以大量共存的離子組是( )
A.K+ Na+ HCO-3NO-3B.Na+ Cl- ClO-SO2-4C.H+ Mg2+ SO2-4NO-3D.Ag+ K+ Na+NO-3組卷:16引用:25難度:0.9 -
5.下列各組物質的無色溶液,不用其它試劑即可鑒別的是( )
①KOH AlCl3 ②Na2CO3 H2SO4 ③NaAlO2 NaHSO4 ④Na2CO3 BaCl2.A.①②③ B.②③④ C.①③④ D.②③④ 組卷:10引用:2難度:0.7 -
6.在鐵和銅的混合物中,加入一定量的稀硝酸,使之充分反應,剩余金屬m1g,再向其中加入一定量的稀硫酸,充分振蕩后,剩余金屬m2 g,則m1與m2關系是( )
A.m1一定大于m2 B.m1可能小于m2 C.m1可能等于m2 D.m1一定等于m2 組卷:277引用:26難度:0.5 -
7.下列有關物質檢驗的實驗結論正確的是( )
選項 實驗操作及現象 實驗結論 A 向某溶液中加入用鹽酸酸化的氯化鋇溶液,有白色沉淀生成 該溶液中一定含有 SO2-4B 向某溶液中加入2滴KSCN溶液,溶液不顯紅色;再向溶液中加入幾滴新制的氯水,溶液變為紅色 該溶液中一定含有Fe2+ C 將某氣體通入品紅溶液中,品紅溶液褪色 該氣體一定是SO2 D 向少量某物質的稀溶液中滴加稀鹽酸,產生了能使澄清石灰水變渾濁的氣體 該物質一定是碳酸鹽 A.A B.B C.C D.D 組卷:196引用:51難度:0.9
三、非選擇題
-
20.銅是一種重要的金屬元素,銅元素與銀元素同處第ⅠB族,+1價的銅和+1價的銀都可形成二配位的絡離子,如Ag(NH3)2+、AgCl2-等,含銅最豐富的天然資源是黃銅礦(CuFeS2).
(1)從黃銅礦冶煉粗銅的傳統工藝是將精選后的富銅礦砂與空氣在高溫下煅燒,使其轉變為銅.這種方法的缺點是、.
(2)現有一種濕法冶煉技術,以黃銅礦為主要原料來生產銅、鐵紅顏料和可用于橡膠硫化的硫單質,原料的綜合利用率較高.其主要流程如下: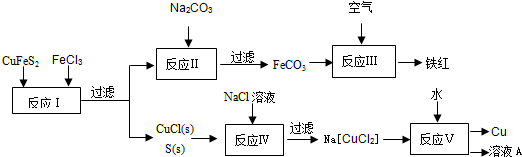
①寫出反應Ⅰ中FeCl3與CuFeS2所發生反應的化學方程式:;
②寫出反應Ⅳ中發生反應的離子方程式:.
③反應Ⅲ是FeCO3在空氣中煅燒,寫出化學方程式:.
④反應Ⅴ所得溶液A中含有的溶質有.組卷:21引用:2難度:0.5 -
21.CuCl和CuCl2都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等。已知:①CuCl可以由CuCl2用適當的還原劑如SO2、SnCl2等還原制得:
2Cu2++2Cl-+SO2+2H2O2CuCl↓+4H++SO42-△
2CuCl2+SNCl2=2CuCl↓+SnCl4
②CuCl2溶液與乙二胺(H2N-CH2-CH2-NH2)可形成配離子: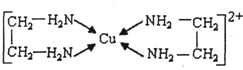
請回答下列問題:
(1)基態Cu原子的核外電子排布式為。H、N、O三種元素的電負性由大到小的順序是。
(2)SO2分子的空間構型為。與SnCl4互為等電子體的一種離子的化學式為。
(3)乙二胺分子中氮原子軌道的雜化類型為。乙二胺和三甲胺[N(CH3)3]均屬于胺,但乙二胺比三甲胺的沸點高的多,原因是。
(4)②中所形成的配離子中含有的化學鍵類型有。(填字母)
a.配位鍵 b.極性鍵 c.離子鍵 d.非極性鍵
(5)CuCl的晶胞結構如右圖所示,其中Cl原子的配位數為。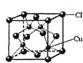 組卷:16引用:3難度:0.6
組卷:16引用:3難度:0.6


