2017-2018學年四川省成都市龍泉中學高三(上)第5周周考化學試卷
發布:2024/10/26 14:0:1
一、單項選擇題(每小題6分,共42分)
-
1.下列有關敘述正確的是( )
A.“殲-20”飛機上大量使用的碳纖維是一種新型的有機高分子材料 B.鋁合金的大量使用是因為人們能用氫氣等還原劑從氧化鋁中獲取鋁 C.2014年德美科學家因開發超分辨率熒光顯微鏡獲諾貝爾化學,使光學顯微鏡分辨率步入納米時代.利用此類光學顯微鏡可以具有丁達爾效應的分散系中分散質 D.酸堿指示劑變色、煤的液化、海水提取溴、焰色反應都涉及化學變化 組卷:36引用:5難度:0.9 -
2.設NA為阿伏加德羅常數的數值,下列說法正確的是( )
A.常溫常壓下,22.4L氧氣與金屬鈉完全反應,轉移的電子數一定是4NA B.常溫常壓下,1.7gH2O2中含有電子數為0.9NA C.1L 0.2 mol?L-1 FeCl3溶液中,含有Fe3+粒子數為0.2 NA D.標準狀況下,0.1mol 甲苯所含C-C鍵數為0.6NA 組卷:10引用:2難度:0.9 -
3.用CaSO4代替O2與燃料CO反應是一種高效、清潔的新型燃燒技術.反應如下:
①CaSO4(s)+CO(g)?14CaS(s)+CO2(g)△H1=-47.3 kJ?mol-114
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ?mol-1
③CO(g)?C(s)+12CO2(g)△H3=-86.2kJ?mol-1.12
下列說法錯誤的是( )A.反應①達到平衡時,增大壓強平衡不移動 B.反應②的平衡常數表達式為K= c(CO2)?c(SO2)C(CO)C.反應①和②是主反應,反應③是副反應 D.2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放熱反應 組卷:34引用:4難度:0.7
二、非選擇題(本題包括4小題,共58分)
-
10.ZrO2常用作陶瓷材料,可由鋯英砂(主要成分為ZrSiO4,也可表示為ZrO2?SiO2,還含少量Fe2O3、Al2O3、SiO2等雜質)通過如圖方法制取.
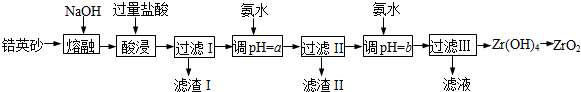
已知:①ZrO2能與燒堿反應生成可溶于水的Na2ZrO3,Na2ZrO3與酸反應生成ZrO2+.
②部分金屬離子在實驗條件下開始沉淀和完全沉淀的pH如表.
(1)熔融時ZrSiO4發生反應的化學方程式為金屬離子 Fe3+ Al3+ ZrO2+ 開始沉淀時pH 1.9 3.3 6.2 沉淀完全時pH 3.2 5.2 8.0 ,濾渣I的化學式為.
(2)為使濾液I的雜質離子沉淀完全,需用氨水調pH=a,則a的范圍是;繼續加氨水至pH=b時,所發生反應的離子方程式為.
(3)向過濾Ⅲ所得濾液中加入CaCO3粉末并加熱,得到兩種氣體.該反應的離子方程式為.
(4)為得到純凈的ZrO2,Zr(OH)4需要洗滌,檢驗Zr(OH)4是否洗滌干凈的方法是.組卷:65引用:10難度:0.5 -
11.A、B、C、D、E、F為原子序數依次增大的六種元素,其中A、B、C、D、E為短周期元素,F為第四周期元素,F還是前四周期中電負性最小的元素。
已知:A原子的核外電子數與電子層數相等;B元素原子的核外p電子數比s電子數少1個;C原子的第一至第四電離能為I1=738kJ?mol-1,I2=1 451kJ?mol-1,I3=7 733kJ?mol-1,I4=10 540kJ?mol-1;D原子核外所有p軌道為全充滿或半充滿;E元素的族序數與周期序數的差為4。
(1)寫出E元素在周期表中位置:;D元素的原子的核外電子排布式:。
(2)某同學根據題目信息和掌握的知識分析C的核外電子排布為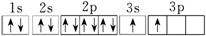 .該同學所畫的軌道式違背了。
.該同學所畫的軌道式違背了。
(3)已知BA5為離子化合物,寫出其電子式:。
(4)DE3中心原子雜化方式為,其空間構型為。組卷:69引用:3難度:0.3


