2022-2023學年山東省濰坊市五縣市聯考高三(上)質檢化學試卷(10月份)
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題目要求。
-
1.化學與生產、生活密切相關。下列說法正確的是( )
A.絲、毛、棉、麻等天然纖維主要化學成分都是纖維素 B.計算機芯片、光導纖維、太陽能電池板的化學成分都是高純硅 C.空氣質量監測中“PM2.5”是指直徑大小在2.5pm范圍的固體顆粒 D.控制NOx、SOx排放是防治酸雨的主要措施 組卷:33引用:1難度:0.8 -
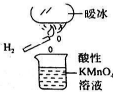 2.20℃時水分子在強電場中可瞬間凝固形成“暖冰”,某興趣小組做如圖所示實驗,發現燒杯中酸性KMnO4溶液褪色,且有氣泡產生,將酸性KMnO4溶液換成FeCl3溶液,燒杯中溶液顏色無變化,但有氣泡產生,則下列說法正確的是( )
2.20℃時水分子在強電場中可瞬間凝固形成“暖冰”,某興趣小組做如圖所示實驗,發現燒杯中酸性KMnO4溶液褪色,且有氣泡產生,將酸性KMnO4溶液換成FeCl3溶液,燒杯中溶液顏色無變化,但有氣泡產生,則下列說法正確的是( )A.水凝固形成“暖冰”時發生了化學變化 B.“暖冰”是H2O和H2O2形成的混合物 C.該條件下H2與O2反應可能產生H2O2 D.該條件下H2與H2O反應可能產生H2O2 組卷:1引用:1難度:0.7 -
3.2Na2S2O3+I2═ 2NaI+Na2S4O6是定量分析中的常用反應。下列關于說法不正確的是( )
A.反應中,I2表現了氧化性 B.反應中,每生成1mol Na2S4O6,有4mol e-發生轉移 C.Na2S2O3是含有共價鍵的離子化合物 D.Na2S2O3在空氣中放置會變質,產物可能有Na2SO4 組卷:43引用:4難度:0.8 -
4.“社會性科學議題”中有許多議題與化學密切相關,例如:應對重污染天氣。我國科學家用下列實驗進行研究空氣中的硫酸鹽會加劇霧霾形成的成因:反應室底部盛有不同的吸收液,將NO2和SO2按一定比例混合,以空氣或N2為載氣通入反應室,相同時間后,檢測吸收液中SO42-的質量分數,數據記錄如下:
下列說法不正確的是( )反應室 載氣 吸收液 SO42-的質量分數 數據分析 ① N2 蒸餾水 a i:b≈d>a≈c1
ii:若起始不通入
NO2,則最終檢測不
到SO42-② 質量分數為3%的氨水 b ③ 空氣 蒸餾水 c ④ 質量分數為3%的氨水 d A.反應室①中可能發生反應:SO2+2NO2+2H2O═H2SO4+2HNO2 B.農業生產中大量使用銨態氮肥不會加重霧霾的形成 C.控制SO2和氮氧化物的排放可以有效減少霧霾的產生 D.本研究表明:硫酸鹽的形成與空氣中的O2含量關系不大 組卷:8引用:1難度:0.6 -
5.已知Pb2O3與HNO3溶液發生反應Ⅰ:Pb2O3+2HNO3=PbO2↓+Pb(NO3)2+H2O,PbO2與酸化的MnSO4溶液發生反應Ⅱ:5PbO2+2MnSO4+3H2SO4=5PbSO4+2HMnO4+2H2O,下列說法正確的是( )
A.在反應Ⅰ中,Pb2O3既是氧化劑,又是還原劑 B.Pb2O3與濃鹽酸可能發生反應Pb2O3+6HCl(濃)=2PbCl2+Cl2↑+3H2O C.PbO與稀HNO3溶液反應3PbO+8HNO3=3Pb(NO3)4+2NO↑+4H2O D.由反應Ⅰ、Ⅱ可知氧化性:HNO3>PbO2>HMnO4 組卷:18引用:1難度:0.6 -
6.下列離子方程式書寫錯誤的是( )
A.Cl2通入冷的NaOH溶液;Cl2+2OH-=Cl-+ClO-+H2O B.用醋酸和淀粉-KI溶液檢驗加碘鹽中的IO3-:IO3-+5I-+6CH3COOH=3I2+3H2O+6CH3COO- C.FeSO4溶液中加入H2O2產生沉淀:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+ D.NaHCO3溶液與少量的Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O 組卷:15引用:1難度:0.7
三、非選擇題:本題共5小題,共60分。
-
19.鈷具有廣泛用途,其正三價化合物具有強氧化性。利用含鈷廢料(主要成分為CoO、Co2O3、LiCoO2,還含有少量的鋁箔)制備碳酸鈷和碳酸鋰的工藝流程如圖1所示:
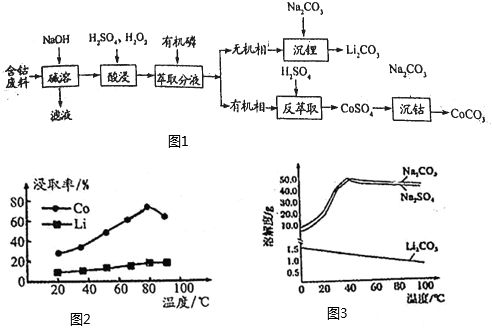
(1)堿溶過程中要保持強制通風,原因是。
(2)酸浸過程中LiCoO2發生反應的方程式,Co、Li元素的浸出率隨溫度的變化如圖2所示,酸浸時最適宜溫度是℃,在生產過程中不能用鹽酸浸出鈷的主要原因是。
(3)在萃取分液的過程中,把分液漏斗玻璃塞上的凹槽對準漏斗口上的小孔,其目的是。
(4)沉鋰過程中有關物質的溶解度隨溫度變化如圖3所示,獲取Li2CO3的操作依次是、洗滌、干燥。
(5)在空氣中煅燒CoCO3生成鈷的氧化物和CO2,測得充分煅燒后固體質量為36.15g,CO2的體積為10.08L(標準狀況),則該鈷氧化物的化學式為。組卷:8引用:1難度:0.7 -
20.SnCl4常用作媒染劑,有機合成的氯化催化劑。常溫下為無色液體,沸點為114.4℃。在空氣中因易水解而發煙,能與氨水反應生成Sn(OH)4沉淀,Sn(OH)4能溶于強酸和強堿。用錫粉與氯氣反應制備無水SnCl4的實驗裝置(加持和加熱裝置略去)如圖所示。
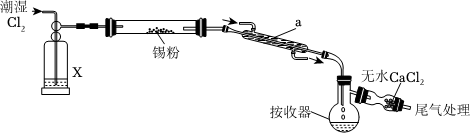
回答下列問題:
(1)實驗室中用KMnO4固體制取Cl2,該反應的離子方程式為,試劑X的化學名稱為,儀器a的名稱為。
(2)無水CaCl2的作用是。
(3)反應結束后應繼續通入一段時間Cl2,主要目的是。
(4)用滴定法測定SnCl4的產率:實驗用ag干燥錫粉,共得到無水SnCl4bmL。取cmL所得SnCl4加入足量Sn粉充分反應,減壓過濾,向濾液中加入適量稀硫酸酸化。然后用nmol?L-1K2Cr2O7標準溶液滴定,滴定終點時消耗K2Cr2O7標準溶液VmL。所得SnCl4的產率為。若過濾后所得濾液中仍有少量Sn粉,計算所得SnCl4的產率(填“偏大”、“偏小”或“無影響”)。主要反應有:SnCl4+Sn=2SnCl2;Cr2+14H++3Sn2+=3Sn4++2Cr3++7H2O。O2-7組卷:3引用:1難度:0.6


