2021-2022學年山東省棗莊市薛城區高二(上)期中化學試卷
發布:2024/11/27 13:0:2
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題意。
-
1.下列不屬于新能源的是( )
A.石油 B.太陽能 C.地熱能 D.生物質能 組卷:7引用:3難度:0.8 -
2.下列說法中,錯誤的是( )
A.錫銅合金在濕潤環境中比干燥環境中更易生銹 B.生鐵(鐵碳合金)比純鐵更易生銹 C.鋼柱在水下比在空氣與水的交界處更易生銹 D.船舶浸在水中的部分掛有鋅塊能防止船泊生銹 組卷:8引用:2難度:0.5 -
3.下列關于反應△U的說法中,正確的是( )
A.△U>0時,反應釋放能量 B.△U<0時,反應釋放能量 C.△U=Q D.△U=ΔH 組卷:4引用:2難度:0.5 -
 4.如圖中曲線表示一定條件下一定量的鋅粒與足量的稀硫酸反應的過程。若使曲線b變為曲線a,可采取的措施是( )
4.如圖中曲線表示一定條件下一定量的鋅粒與足量的稀硫酸反應的過程。若使曲線b變為曲線a,可采取的措施是( )A.加入醋酸鈉固體 B.加熱使溫度升高 C.加入氯化鈉固體 D.加入少量的硫酸銅固體 組卷:4引用:1難度:0.7 -
5.研究氮氧化物與懸浮在大氣中海鹽粒子的相互作用時,涉及如下反應:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1ΔH1<0;
2NO(g)+Cl2(g)?2ClNO(g)K2ΔH2<0;
則反應4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數是( )A. ÷K2K21B.2K1-K2 C.2K1÷K2 D. -K2K21組卷:34引用:3難度:0.6 -
6.已知:2N2O5(g)?4NO2(g)+O2(g),該反應消耗2mol N2O5需吸收QkJ的熱量。某溫度下,向2L的密閉容器中通入N2O5,部分實驗數據如表:
下列說法錯誤的是( )時間/s 0 500 1000 1200 n(N2O5)/mol 10.0 7.0 5.0 5.0 A.在500s內,分解速率為3×10-3mol?L-1?s-1 B.在1000s時,反應為平衡狀態 C.1000s內,反應吸收熱量為QkJ D.在1100 s時,N2O5的正反應速率和逆反應速率相等 組卷:2引用:2難度:0.4
三、非選擇題:本題共5小題,共60分。
-
19.合理開發利用能源具有重要意義。回答下列問題:
(1)電化學氣敏傳感器可用于監測環境中NH3的含量,其工作原理如圖所示,NH3被氧化為常見無毒物質。
①電極b的名稱是,電子的流動方向為。
②a極的電極反應式為。
③電池工作時,理論上反應消耗NH3與O2的物質的量之比為。
(2)氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品。如圖是離子交換膜法電解食鹽水的示意圖,圖中的離子交換膜只允許陽離子通過。
①電解飽和食鹽水的離子方程式。
②精制飽和食鹽水從圖中位置補充,氫氧化鈉溶液從圖中位置流出。(選填“a”、“b”、“c”或“d”)
③離子交換膜的作用為:。組卷:8引用:1難度:0.7 -
20.我國力爭于2030年前做到碳達峰,2060年前實現碳中和。因此,研發CO2和CH4等利用技術,降低空氣中二氧化碳含量成為研究熱點。
(1)大氣中的二氧化碳主要來自于煤、石油及其他含碳化合物的燃燒。已知25℃時,相關物質的燃燒熱(焓)數據如下表:
則25℃時H2(g)和C(石墨,s)生成C6H6(l)的熱化學方程式為物質 H2(g) C(石墨,s) C6H6(l) 燃燒焓ΔH/kJ?mol-1 -285.8 -393.5 -3267.5 。
(2)CH4與CO2重整是CO2利用的研究熱點之一。該重整反應體系主要涉及以下反應:
a.CH4(g)+CO2(g)?2CO(g)+2H2(g)ΔH1
b.H2(g)+CO2(g)?CO(g)+H2O(g)ΔH2
c.CH4(g)?C(s)+2H2(g)ΔH3
d.2CO(g)?CO2(g)+C(s)ΔH4
e.H2(g)+CO(g)?C(s)+H2O(g)ΔH5
①上述反應體系在一定條件下建立平衡后,下列說法錯誤的有(填標號)。
A.增大CO2與CH4的濃度,反應a、b、c的正反應速率都增加
B.移去部分C(s),反應c、d、e的平衡均向右移動
C.加入反應a的催化劑,可提高CH4的平衡轉化率
D.降低反應溫度,反應a~e的正、逆反應速率都減小
②一定條件下,CH4分解形成碳的反應歷程如圖1所示。該歷程分步進行,其中,第步的正反應活化能最大。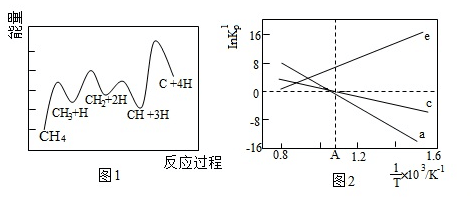
③設為相對壓力平衡常數,其表達式寫法:在濃度平衡常數表達式中,用相對分壓代替濃度。氣體的相對分壓等于其分壓(單位為kPa)除以p0(p0=100kPa)。反應a、c、e的KTp隨lnKTp(溫度的倒數)的變化如圖2所示。則反應a、c、e中,屬于放熱反應的有1T(填字母):反應d的相對壓力平衡常數表達式為=KTp。組卷:325引用:1難度:0.6


