2021年天津市河東區高考化學二模試卷
發布:2024/4/20 14:35:0
一、本題包括12小題,每小題3分,共36分。每小題只有一個選項符合題意
-
1.我國古代人民的智慧為人類文明進步做出了重要貢獻,下列發明創造沒有涉及化學變化的是( )
A.用膽礬冶煉銅 B.火藥的使用 C.用海水曬食鹽 D.用糯米制作米酒 組卷:33引用:1難度:0.8 -
2.實驗室制備乙炔的反應CaC2+2H2O→C2H2↑+Ca(OH)2,CaC2是離子化合物,下列說法不正確的是( )
A.此反應是氧化還原反應 B.乙炔的電子式: 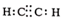
C.C22-中有14個電子 D.Ca(OH)2中既有離子鍵又有共價鍵 組卷:62引用:1難度:0.6 -
3.自來水廠利用鐵屑及FeCl2溶液處理泄漏的Cl2,下列有關說法不正確的是( )
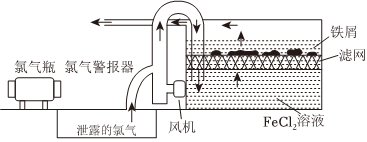
A.Cl2和水反應的離子方程式為:H2O+Cl2?Cl-+HClO+H+ B.吸收泄漏氯氣的離子方程式為:2Fe2++Cl2═2Cl-+2Fe3+ C.鐵屑的作用是將FeCl3還原為FeCl2 D.鐵屑耗盡時溶液中可能大量存在:Fe2+、Fe3+、ClO-、Cl- 組卷:130引用:4難度:0.7 -
4.對于0.1mol/LNa2CO3溶液,下列說法正確的是( )
A.加入NaOH固體,溶液pH減小 B.升高溫度,溶液中c(OH-)增大 C.稀釋溶液,溶液中c(H+)減少 D.c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) 組卷:42引用:2難度:0.7 -
5.用下列儀器或裝置進行相應實驗,不能達到實驗目的的是( )




A.除去SO2中的少量HCl B.配制一定物質的量濃度的氯化鈉溶液 C.檢驗溴乙烷消去產物中的乙烯 D.制取氨氣 A.A B.B C.C D.D 組卷:76引用:2難度:0.5
二、非選擇題,共64分
-
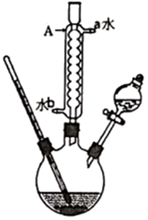 15.乳酸異戊酯是合成香料和工業溶劑的重要原料,實驗室用乳酸與異戊醇反應制備,相關數據和裝置如圖。
15.乳酸異戊酯是合成香料和工業溶劑的重要原料,實驗室用乳酸與異戊醇反應制備,相關數據和裝置如圖。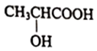 +
+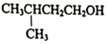 催化劑加熱
催化劑加熱 +H2O
+H2O
實驗步驟:相對分子質量 密度/(g?cm-3) 沸點/℃ 水中溶解度 乳酸 90 1.209 122 溶 異戊醇 88 0.8123 131 微溶 乳酸異戊酯 160 0.96 202 不溶
①如圖連接好裝置,在A中加入0.1mol 乳酸、0.2mol 異戊醇及少量催化劑和2~3片碎瓷片然后開始緩慢加熱。
②反應2小時后,冷卻液體至室溫,倒入分液漏斗中,先水洗,再用溶液洗滌至中性,最后用飽和食鹽水和水洗滌,分出的產物中加入少量無水硫酸鎂固體,靜置片刻。
③過濾除去硫酸鎂固體,再進行蒸餾純化,收集200~203℃餾分,得乳酸異戊酯13.6 g。回答下列問題:
(1)如圖中A儀器的用途是冷凝回流,A的名稱是,A的進水口是(填a或b)。
(2)下列催化劑均可催化該酯化反應,最適合的催化劑是;寫出兩種使用這種催化劑的優點
A.濃硫酸(產率65%)
B.對甲苯磺酸(產率85%)
C.固載雜多酸催化劑(PW12/SiO2) (產率93%)
(3)步驟②水洗后為除去酸性雜質再用溶液洗滌,分離提純過程中加入無水硫酸鎂的目的是。
(4)在蒸餾純化過程中,下列說法錯誤的是。
A.加熱一段時間后發現忘記加瓷片,應該冷卻后再補加
B.溫度計應該插入液面以下
C.冷凝裝置中的冷凝管,可以使用球形冷凝管
D.蒸餾時用到的主要玻璃儀器有:酒精燈、蒸餾燒瓶、冷凝管、溫度計、牛角管、錐形瓶
(5)本實驗中加入過量異戊醇的目的是;本實驗的產率是。組卷:37引用:1難度:0.5 -
16.為改變生橡膠受熱發粘遇冷變硬的不良性能,工業上常將橡膠硫化來改善橡膠的性能,S2Cl2和SCl2均為改善橡膠性能的重要化工產品。
(1)已知下列化學鍵的鍵能及S4的結構式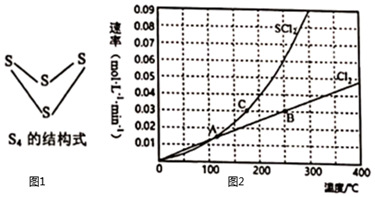
則S4(s)+4Cl2(g)=4SCl2(g)△H=化學鍵 S-S S-Cl Cl-Cl 鍵能/(kJ/mol) 266 255 243 kJ/mol。
(2)S2Cl2的電子式是。
(3)S2Cl2易與水發生反應,反應中只有一種元素的化合價發生變化,產生無色有刺激性氣味的氣體,同時有淡黃色沉淀生成,寫出此反應的化學反應方程式;該反應中被氧化和被還原的元素的質量之比是。
(4)反應S2Cl2 (g)+Cl2(g)?2SCl2(g)△H<0,在一定壓強下,向10 L密閉容器中充入1mol S2Cl2和1mol Cl2發生上述反應,Cl2與SCl2的消耗速率與溫度的關系如圖2所示。
①A、B、C三點對應狀態下,達到平衡狀態的有。(填字母)
②其他條件不變只改變下列一個條件,可以提高S2Cl2平衡轉化率的是。
A.升高體系的溫度
B.增大氯氣的物質的量
C.壓縮容器的體積
D.使用合適的催化劑
③某溫度下,反應達到平衡時S2Cl2 的轉化率是a,用含a的式子表示此反應的化學平衡常數K=。
(5)SCl2與SO3反應可以制備亞硫酰氯(SOCl2),鋰、亞硫酰氯(Li/SOCl2)電池是一種比能量最高的電池,若正極反應為2SOCl2+4e-═SO2+S+4Cl-,負極反應式為。組卷:54引用:1難度:0.5


