2020-2021學年江西省萍鄉市蓮花中學高一(下)第一次月考化學試卷
發布:2024/11/3 15:30:2
一、選擇題(每小題只有一個正確答案,每小題3分,共48分)
-
1.下列屬于未來新能源的是( )
①天然氣 ②煤 ③核能 ④石油 ⑤太陽能 ⑥生物質能 ⑦風能 ⑧氫能.A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ 組卷:24引用:4難度:0.9 -
2.科學家最近發現兩種粒子:第一種是由四個中子構成的粒子,這種粒子稱為“四中子”,也有人稱之為“零號元素”;第二種是由四個氧原子構成的分子。下列有關這兩種粒子的說法不正確的是( )
A.“四中子”的粒子不顯電性 B.“四中子”的質量數為4 C.第二種粒子是氧元素的另一種同位素 D.第二種粒子的化學式為O4 組卷:26引用:1難度:0.7 -
3.下列化學用語書寫不正確的是( )
A.中子數為1的氫原子: H21B.HCl的電子式: 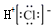
C.Na+的結構示意圖: 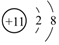
D.CH4的結構式: 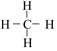 組卷:4引用:1難度:0.7
組卷:4引用:1難度:0.7 -
4.下列敘述中,不正確的是( )
A.HCl溶于水時要破壞離子鍵 B.CCl4和NH3都是只含有極性鍵的共價化合物 C.Na2O2是含有非極性鍵的離子化合物 D.CaO和NaCl晶體熔化時要破壞離子鍵 組卷:18引用:2難度:0.7 -
5.下列說法不正確的是( )
A.等量的硫蒸氣和硫固體分別完全燃燒,前者放出的熱量多 B.由C(石墨)→C(金剛石)△H=+1.9kJ/mol,可知石墨比金剛石穩定 C.生成物總能量高于反應物總能量的反應是吸熱反應 D.需要加熱才能發生的反應一定是吸熱反應 組卷:22引用:2難度:0.5 -
6.類比推理是化學中常用的思維方法。下列推理正確的是( )
A.CH4分子是正四面體結構,推測SiH4分子也是正四面體結構 B.H2O的沸點高于H2S,推測CH4的沸點高于SiH4 C.Cl2能與NaBr溶液反應生成Br2,推測F2與NaCl溶液反應生成Cl2 D.NaCl與濃H2SO4加熱可制HCl,推測NaI與濃H2SO4加熱可制HI 組卷:16引用:1難度:0.6 -
7.下列變化過程,屬于放熱反應的是( )
①工業合成氨
②酸堿中和反應
③水蒸氣變成液態水
④固體NaOH溶于水
⑤Na在Cl2中燃燒
⑥食物腐敗
⑦濃H2SO4稀釋。A.①②③④⑤⑥⑦ B.②③④⑤ C.①②⑤⑥ D.①②⑤⑥⑦ 組卷:30引用:4難度:0.7
二、填空題(5小題,共52分)
-
20.實驗室用50mL 0.50mol/L的鹽酸與50mL 0.55mol/L的NaOH溶液進行實驗室的中和熱測定,試回答下列問題:
(1)在本實驗中除了用到大燒杯、小燒杯、溫度計、量筒等儀器外,還需用到的一種玻璃儀器名稱為,兩只燒杯間要填碎泡沫塑料,其目的是,大燒杯上必須蓋上硬紙板,否則求得的中和熱數值將(填“偏大”、“偏小”或“無影響”)。
(2)某學生實驗記錄數據如下:(已知中和后生成溶液的比熱容c=4.18J/(g?℃),又假設鹽酸和氫氧化鈉溶液的密度都是1g/cm3)
依據該學生的實驗數據計算,該實驗測得的中和熱△H=實驗序號 起始溫度t1/℃ 終止溫度t2/℃ 鹽酸 氫氧化鈉 混合溶液 1 20.0 20.2 23.3 2 20.2 20.4 23.4 3 20.4 20.6 23.8 (結果保留三位有效數字)。
(3)上述實驗結果與57.3kJ/mol(常溫下中和熱的數值)有偏差,產生偏差的原因可能是。(填字母)
a.實驗裝置保溫、隔熱效果差
b.用溫度計測定NaOH溶液起始溫度后直接測定鹽酸溶液的溫度
c.用量筒量取鹽酸溶液的體積時仰視讀數
d.分多次把NaOH溶液倒入盛有鹽酸的小燒杯
(4)實驗中改用60mL 0.50mol?L-1鹽酸跟50mL 0.55mol?L-1NaOH溶液進行反應,與上述實驗相比,所放出的熱量(填“相等”或“不相等”),所求中和熱(填“相等”或“不相等”),簡述理由。組卷:28引用:1難度:0.6 -
21.硼酸(H3BO3)為一元弱酸,廣泛用于玻璃、醫藥、冶金、皮革等工業。回答下列問題:
(1)H3BO3中B元素的化合價為,其在元素周期表的位置是。
(2)已知:A(OH)3+H2O?[Al(OH)4]-+H+,H3BO3的電離方程式為。酸性:H3BO3(填“>”或“<”) Al(OH)3。
(3)H3BO3受熱分解得到的B2O3和鎂粉混合點燃可得單質B,生成單質B的化學方程式為。
(4)H3BO3可用于生產儲氫材料NaBH4.涉及的主要反應為:
I.H3BO3+3CH3OH→B( OCH3)3+3H2O
II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①“反應I”的類型為(填標號)。
A.取代反應 B.加成反應 C.加聚反應 D.氧化反應
②NaH的電子式為。
③在堿性條件下,NaBH4與CuSO4溶液反應可得Cu和Na[B(OH)4],其中H元素由-1價升高為+1價,該反應的離子方程式為。組卷:6引用:2難度:0.5


