2021-2022學年福建省龍巖市武平一中高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、單選題(1-10題每小題2分,11-20題每小題2分,共50分)
-
1.化學與生活密切相關。下列敘述錯誤的是( )
A.高純硅可用于制作光感電池 B.使用含有氯化鈉的融雪劑會加快橋梁的腐蝕 C.鋁及其合金是使用廣泛的金屬材料,通常用電解氯化鋁的方法制備鋁 D.電熱水器用鎂棒防止內膽腐蝕,原理是犧牲陽極的陰極保護法 組卷:12引用:1難度:0.5 -
2.下列敘述正確的是( )
A.甲烷的燃燒熱為ΔH=-890.3kJ?mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ?mol-1 B.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ?mol-1,則稀H2SO4溶液和稀Ba(OH)2溶液反應的反應熱ΔH=2×(-57.3)kJ?mol-1 C.CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的ΔH=+(2×283.0)kJ/mol D.2SO2(g)+O2(g)?2SO3(g)ΔH=-196.3kJ?mol-1,則1molSO2、0.5molO2充分反應后,放出熱量98.3kJ 組卷:21引用:4難度:0.6 -
3.聯氨(N2H4)常溫下為無色液體,可用作火箭燃料。下列說法不正確的是( )
①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1048.9kJ?mol-1A.△H4=2△H3-2△H2-△H1 B.O2(g)+2H2(g)═2H2O(l)△H5,△H5>△H3 C.1mol O2(g)和2mol H2(g)具有的總能量高于2mol H2O(g) D.聯氨和N2O4作火箭推進劑的原因之一是反應放出大量的熱且產物無污染 組卷:196引用:4難度:0.5 -
4.下列關于化學反應方向及其判據的說法中正確的是( )
A.1molSO3在不同狀態時的熵值:S[SO3(s)]>S[SO3(1)]>S[SO3(g)] B.常溫下,反應C(s)+CO2(g)=2CO(g)不能自發進行,則該反應的ΔH>0 C.放熱反應都可以自發進行,而吸熱反應不能自發進行 D.2KClO3(s)=2KCl(s)+3CO2(g) ΔH>0能否自發進行與溫度無關 組卷:47引用:3難度:0.7 -
5.用惰性電極電解物質的量濃度相同、體積比為3:1的CuSO4溶液和NaCl溶液的混合溶液,不可能發生的反應是( )
A.2Cu2++2H2O 2Cu+4H++O2↑通電B.Cu2++2Cl- Cu+Cl2↑通電C.2Cl-+2H2O 2OH-+H2↑+Cl2↑通電D.2H2O 2H2↑+O2↑通電組卷:87引用:11難度:0.7 -
6.一定條件下:2NO2(g)?N2O4(g)△H<0.在測定NO2的相對分子質量時,下列條件中,測定結果誤差最小的是( )
A.溫度0℃、壓強50kPa B.溫度130℃、壓強300kPa C.溫度25℃、壓強100kPa D.溫度130℃、壓強50kPa 組卷:524引用:34難度:0.6 -
7.下列裝置及設計不能達到實驗目的的是( )
選項 A B C D 裝置 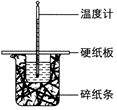
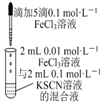
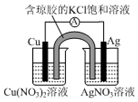
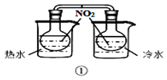
目的 測定中和熱 驗證增大反應物濃度對平衡的影響 組裝銅銀原電池 驗證溫度對平衡移動的影響 A.A B.B C.C D.D 組卷:1引用:1難度:0.5 -
8.下列關于四個裝置說法正確的是( )
A. 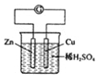
裝置中,電子流向:Zn-導線-銅片-稀硫酸-ZnB. 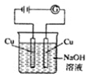
裝置中,陽極反應為4OH--4e-═2H2O+O2↑C. 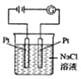
裝置中,在陰極附近滴入酚酞溶液,陰極附近溶液變紅D. 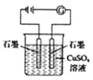
裝置中,電解一段時間后,溶液的pH變大組卷:41引用:2難度:0.5
二、第II卷非選擇題(共50分)
-
23.某小組同學利用原電池裝置探究物質的性質。資料顯示:原電池裝置中,負極反應物的還原性越強,或正極反應物的氧化性越強,原電池的電壓越大。
(1)同學們利用如表中裝置進行實驗并記錄。
①同學們認為實驗Ⅰ中鐵主要發生了析氫腐蝕,其正極反應式是裝置 編號 電極A 溶液B 操作及現象 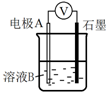
Ⅰ Fe pH=2的H2SO4 連接裝置后,石墨表面產生無色氣泡;電壓表指針偏轉 Ⅱ Cu pH=2的H2SO4 連接裝置后,石墨表面無明顯現象;電壓表指針偏轉,記錄讀數為a 。
②針對實驗Ⅱ現象:甲同學認為不可能發生析氫腐蝕,其推導依據是。
③乙同學認為實驗Ⅱ中應發生吸氧腐蝕,其正極的電極反應式是。
(2)同學們仍用上述裝置并用Cu和石墨為電極繼續實驗,探究實驗Ⅱ指針偏轉原因及影響O2氧化性因素。
①丙同學比較實驗Ⅱ、Ⅲ、Ⅳ的電壓表讀數為:c>a>b,請解釋原因是編號 溶液B 操作及現象 Ⅲ 經煮沸的pH=2的H2SO4 溶液表面用煤油覆蓋,連接裝置后,電壓表指針微微偏轉,記錄讀數為b Ⅳ pH=2的H2SO4 在石墨一側緩慢通入O2并連接裝置,電壓表指針偏轉,記錄讀數為c;取出電極,向溶液中加入數滴濃Na2SO4溶液混合后,插入電極,保持O2通入,電壓表讀數仍為c Ⅴ pH=12的NaOH 在石墨一側緩慢通入O2并連接裝置,電壓表指針偏轉,記錄讀數為d 。
②丁同學對Ⅳ、Ⅴ進行比較,其目的是探究對O2氧化性的影響;實驗Ⅳ中加入Na2SO4溶液的目的是。組卷:40引用:2難度:0.5 -
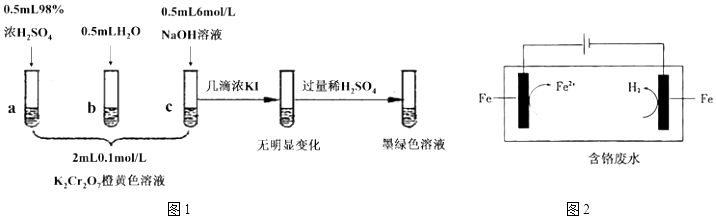
24.研究+6價鉻鹽不同條件下微粒存在形式及氧化性,某小組同學進行如圖1實驗:
已知:①Cr2O72-(aq)(橙色)+H2O(l)?2CrO42-(aq)(黃色)+2H+(aq)△H1=+13.8kJ?mol-1
②+6價鉻鹽在一定條件下可被還原為Cr3+,Cr3+在水溶液中為墨綠色。
(1)對比試管c和b,推測試管c的現象是:。
(2)對比試管a和b,發現a中溶液橙色比b的更深,請用平衡移動理論分析原因:。
(3)寫對比試管a、b、c的實驗現象,若pH增大,則c(Cr2O2-7)c(CrO2-4)(選填“增大”,“減小”,“不變”);
(4)分析如圖試管c中滴加KI溶液無明顯現象、繼續滴加過量稀H2SO4溶液變成墨綠色,由此實驗現象,說明+6價鉻鹽氧化性強弱為Cr2O72-CrO42-(填“大于”,“小于”,“不確定”)。
(5)工業上用電解還原法處理酸性含鉻廢水:以鐵板做陰、陽極,電解含鉻廢水,示意圖如圖2:
①陽極電極反應Fe-2e-═Fe2+。產生的Fe2+將Cr2O72-還原為Cr3+的離子方程式為。
②陰極區的pH(填“增大”或“減小”),使Cr3+、Fe3+形成Cr(OH)3、Fe(OH)3沉淀。
③隨著電解的進行,陽極鐵板會發生鈍化,表面形成FeO?Fe2O3的鈍化膜,使電解池不能正常工作。將陰極鐵板與陽極鐵板交換使用,一段時間后,鈍化膜消失。結合有關反應,解釋鈍化膜消失的原因組卷:9引用:2難度:0.4


