2022-2023學年山東省濰坊市高三(上)期中化學試卷(A卷)
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題目要求。
-
1.化學與生產、生活、環保等息息相關。下列敘述錯誤的是( )
A.應用放射線同位素發出的射線進行金屬制品探傷 B.汽車尾氣中的NO和CO可在催化劑作用下迅速變成CO2和N2 C.可利用大理石粉與水混合得到的漿狀物對燃煤產生的廢氣進行脫硫處理 D.誤服可溶性鋇鹽后應盡快用5%的CuSO4溶液洗胃 組卷:35引用:4難度:0.5 -
2.下列生產過程不涉及氧化還原反應的是( )
A.高爐煉鐵 B.工業制硫酸 C.用NH3、CO2和飽和食鹽水制備純堿 D.海水提溴 組卷:48引用:6難度:0.7 -
3.下列物質的應用過程中不涉及鹽類水解的是( )
A.小蘇打用作食品膨松劑 B.硫酸鋁鉀作凈水劑 C.熱堿水清洗廚房里的油污 D.NaH2PO4-Na2HPO4組成pH為7.5的緩沖溶液 組卷:22引用:3難度:0.7 -
4.下列實驗對應的結論錯誤的是( )
A.向品紅溶液中通入二氧化硫氣體,品紅溶液褪色,證明二氧化硫具有漂白性 B.向常溫下的濃硫酸中加入銅片,無明顯現象,證明濃硫酸使銅片鈍化 C.向KSCN和FeSO4混合溶液中滴加氯水,溶液變成紅色,證明氯水具有氧化性 D.NH3通過灼熱的CuO,黑色固體逐漸變為紅色,證明NH3具有還原性 組卷:45引用:5難度:0.7 -
5.下列實驗中,所選用的實驗儀器(夾持裝置略)能完成相應實驗的是( )
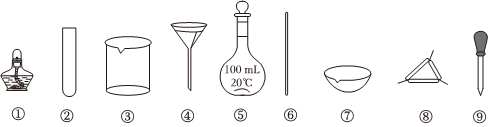
A.灼燒干海帶:選用①、⑦ B.除去BaSO4中的少量BaCO3:選用③、④和⑥ C.配制100mL0.1mol?L-1的NaOH溶液:選用③、⑤、⑥ D.NaCl溶液的蒸發結晶:選用①、⑦和⑧ 組卷:26引用:5難度:0.5 -
6.下列說法錯誤的是( )
A.Mg、Fe在一定條件下都能與水反應生成H2和相應的堿 B.稀硫酸中加入銅粉,銅粉不溶解,若再繼續加入KNO3固體,銅粉會溶解 C.已知Na3N與鹽酸反應生成NaCl和NH4Cl,則Mg3N2與鹽酸反應生成MgCl2和NH4Cl D.25℃時,100mLpH為10的Na2CO3溶液中水電離出H+的物質的量為1.0×10-5mol 組卷:18引用:4難度:0.7
三、非選擇題:本題共5小題,共60分。
-
19.鋨酸鉀晶體(K2OsO4?2H2O)微溶于冷水,常用作催化劑。由含鋨約1g?L-1的鋨吸收液(主要成分為Na2OsO4,含少量Na2RuO4及Ca2+、Mg2+雜質)精制提純鋨酸鉀的工業流程如圖:
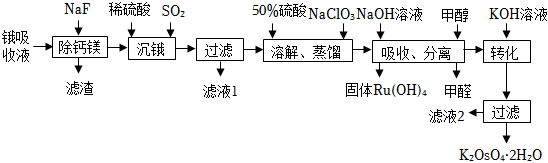
已知:四氧化鋨(OsO4)的熔點為41℃,沸點為130℃,易揮發
回答下列問題:
(1)“沉鋨”得到難溶物(Na2O)3OsO3(SO2)4?5H2O,該化合物中鋨元素的化合價為。
(2)檢驗濾液1和濾液2中金屬陽離子的實驗方法是。
(3)“溶解、蒸餾”步驟中,先加入50%硫酸得到Na2OsO4溶液,再加入NaClO3反應后蒸餾出OsO4,生成OsO4的離子反應方程式為。
(4)OsO4用NaOH溶液吸收后又得到Na2OsO4溶液,吸收液中仍然存在少量Na2RuO4雜質,“吸收、分離”操作加入甲醇的目的是。流程中從初始的鋨吸收液到“吸收、分離”操作的目的是。
(5)“轉化”時須加入過量KOH溶液,用平衡原理解釋其原因。
(6)已知:Ksp(MgF2)=9×10-9、Ksp(CaF2)=1.5×10-10。鋨吸收液中Ca2+、Mg2+濃度分別為0.02mol?L-1和0.01mol?L-1,若取1.0L廢液,則至少需加入gNaF才能使廢液中Ca2+、Mg2+沉淀完全(當離子濃度c≤1×10-5mol?L-1,可認為沉淀完全)。組卷:30引用:3難度:0.3 -
20.落實“雙碳”目標,發展綠色能源,首先是對氫能源的開發利用。利用甲烷制氫是當前研究的熱點。涉及的反應如下:
反應Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH1=+206kJ?mol-1
反應Ⅱ:CH4(g)+2H2O(g)?CO2(g)+4H2(g)ΔH2=+165kJ?mol-1
反應Ⅲ:CO(g)+H2O(g)?CO2(g)+H2(g)ΔH3=-41kJ?mol-1
回答下列問題:
(1)反應Ⅰ的活化能為240.1kJ?mol-1,反應Ⅰ逆反應的活化能為kJ?mol-1。研究發現,以單一負載型Ni催化反應Ⅰ時,反應Ⅰ的逆反應在催化劑表面存在兩種活性中心,分別以“*”和“#”表示,在活性位“*”上發生CO吸附,在活性位“#”上被吸附的CO發生分解反應生成表面碳,表面碳再與H2結合生成CH4,其催化反應機理的反應式如下:
ⅰ.CO+*?CO*快速平衡
ⅱ.CO*+?#O*+C#慢反應
ⅲ.C#+2H2?CH4+#快反應
ⅳ.快反應
反應ⅳ的反應式為;反應Ⅰ逆反應的決速步驟是(填反應序號)。
(2)T℃時,在某密閉容器中通入一定量的CH4(g)和H2O(g),加入金屬鎳做催化劑,在一定溫度下發生上述反應。
①為提高CH4(g)的平衡轉化率,除改變溫度外,還可以采取的措施是。
②恒溫恒容條件下,起始時CH4(g)和H2O(g)的濃度分別為amol?L-1和bmol?L-1,達平衡時CO和CO2的濃度分別為cmol?L-1和dmol?L-1。達平衡時,H2O的濃度是mol?L-1,反應Ⅰ的平衡常數K是。(用含a、b、c、d的代數式表示)
③在該溫度下,反應Ⅲ的標準平衡常數Kθ=。[已知:分壓=總壓×該組分物質的量分數,對于反應dD(g)+eE(g)?gG(g)+hH(g),Kθ=,其中pθ=100kPa,pG、pH、pD、pE為各組分的平衡分壓](pGpθ)g?(pHpθ)h(pDpθ)d?(pEpθ)e
(3)在某一給定進料比的情況下,溫度、壓強對平衡體系中H2物質的量分數的影響如圖: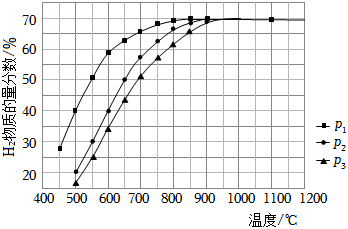
壓強由大到小的順序為,體系溫度未達到400℃時,H2物質的量分數幾乎為0的原因是。組卷:26引用:3難度:0.7


