2022-2023學年遼寧省實驗中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題(包含15小題,每小題3分,共45分,每題只有一個選項符合題意)
-
1.自發過程:在一定的條件下,不需要外力就可以自動進行的過程。在常溫常壓下,下列詩句反映的景象與自發過程不一致的一項是( )
A.云開霧散旭風暖 B.飛流直下三千尺 C.雪消門外千山綠 D.欲渡黃河冰塞川 組卷:25引用:5難度:0.9 -
2.“不用開水,不用火電,自熱米飯真方便!”這是某品牌“自熱米飯”的廣告詞。加熱米飯的熱量來自飯盒內貯存的某些特殊物質,當這些物質混合后就會發生劇烈的變化而釋放出大量熱量,則這些特殊物質最可能是( )
A.濃硫酸和水 B.生石灰和水 C.硝酸銨和水 D.燒堿和水 組卷:32引用:6難度:0.7 -
3.已知:①S(g)+O2(g)═SO2(g)ΔH1;
②S(s)+O2(g)═SO2(g)ΔH2;
③2H2S(g)+O2(g)═2S(s)+2H2O(l)ΔH3;
④2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)ΔH4;
⑤SO2(g)+2H2S(g)═3S(s)+2H2O(l)ΔH5。
下列關于上述反應焓變的判斷不正確的是( )A.ΔH1<ΔH2 B.ΔH5=ΔH3-ΔH2 C.ΔH3<ΔH4 D.2ΔH5=3ΔH3-ΔH4 組卷:42引用:3難度:0.7 -
4.已知:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ/mol。某小組用溶液25.00mL0.50mol/L氫氧化鈉溶液和25.00mL0.50mol/L硫酸溶液進行反應熱的測定,實驗測得ΔH=-53.5kJ/mol。該值與理論值產生偏差的原因不可能是( )
A.實驗裝置保溫、隔熱效果差 B.量取NaOH溶液的體積時仰視讀數 C.分多次把NaOH溶液倒入盛有硫酸的小燒杯中 D.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度 組卷:40引用:1難度:0.5 -
 5.臭氧分解過程如圖所示,下列說法正確的是( )
5.臭氧分解過程如圖所示,下列說法正確的是( )A.催化反應①②均為放熱反應 B.在催化反應中,決定O3分解反應速率的是催化反應② C.E1是催化反應①對應的正反應的活化能,(E2+|ΔH|)是催化反應②對應的逆反應的活化能 D.溫度升高,總反應的正反應速率增加,逆反應速率減小 組卷:22引用:1難度:0.7 -
 6.在一恒溫體積可變的密閉容器中發生如下反應:A(g)+B(g)?2C(g) ΔH<0,t1時刻達到平衡后,在t2時刻改變條件,其反應過程如圖。下列說法正確的是( )
6.在一恒溫體積可變的密閉容器中發生如下反應:A(g)+B(g)?2C(g) ΔH<0,t1時刻達到平衡后,在t2時刻改變條件,其反應過程如圖。下列說法正確的是( )A.0~t1時,v正<v逆 B.t2時刻改變的條件可能只是加催化劑 C.t2時刻改變的條件可能只是升高了溫度 D.Ⅰ、Ⅱ兩過程達到反應限度時,無法確定Ⅰ、Ⅱ中A的物質的量哪個多 組卷:22引用:2難度:0.5
二、非選擇題,共55分)
-
18.工業上常利用合理的催化劑,將含碳氧化物轉化為重要的化工原料一甲醇,由CO、CO2和H2合成甲醇發生的主要反應如下:
Ⅰ.CO(g)+2H2(g)?CH3OH(g) ΔH1=-99kJ/mol
Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH2=-58kJ/mol
(1)已知反應Ⅰ中相關的化學鍵鍵能數據如下表,則x=。
(2)對于反應Ⅱ,化學鍵 H-H C-O C OH-O C-H E/(kJ?mol-1) 436 343 1076 465 x (填“高溫”或“低溫”)有利于反應自發進行。
(3)T℃時將6molCO2和8molH2充入恒溫密閉容器中發生反應Ⅱ,測得H2的物質的量隨時間變化如圖a中狀態Ⅰ(圖中白色柱狀圖A、B、C、D、E)所示。圖中數據A(1,6)代表在1min時H2的物質的量是6mol。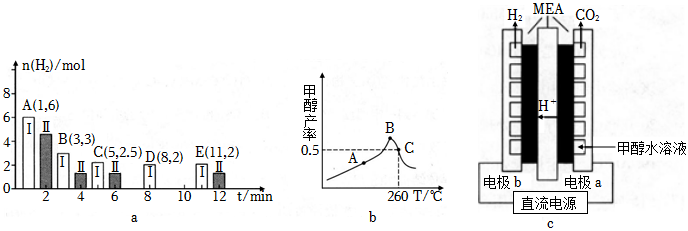
①若T℃時控制體積為2L不變,狀態Ⅰ情況下,0~8min內CH3OH的平均化學反應速率為。
②若僅改變一個條件,使化學平衡變為狀態Ⅱ(如圖中灰色柱狀圖所示),則狀態Ⅰ和狀態Ⅱ的化學平衡常數分別為K1、K2,其大小關系為。
(4)CO和H2在耐高溫催化劑、一定溫度下發生反應Ⅰ合成甲醇。圖(b)為在容積為1L的恒容密閉容器中,加入2molH2和1mol CO時經過相同時間甲醇產率與反應溫度的關系曲線。曲線上A點(填“是”或“不是”)對應溫度下的平衡產率;理由是。
(5)一種以MEA膜為電極的電解甲醇溶液制氫法如圖c。總反應方程式為CH3OH+H2O═H2+CO2(未配平)。
①陽極反應方程式為。
②陰陽兩極產物的物質的量之比為:。組卷:16引用:1難度:0.5 -
19.黨的二十大報告提出未來我國將用更高的標準深入打好污染物防治攻堅戰,統籌減污降碳,所以深入研究碳、氮元素的物質轉化有著重要的實際意義,工業上合成尿素的反應:
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)ΔH
(1)已知合成尿素的反應分兩步進行:2NH3(g )+CO2(g )?NH2COONH4(s)ΔH1
NH2COONH4(s)?CO(NH2)2(l)+H2O(g)ΔH2
其能量變化曲線如圖1所示,則ΔH、ΔH1和ΔH2由大到小的順序為。
(2)若向某恒溫且恒容的密閉容器中加入等物質的量的NH3和CO2,發生上述反應。下列敘述不能說明反應已經達到平衡狀態的是(填標號)。
A.斷裂6mol N—H鍵的同時斷裂2mol O—H鍵
B.壓強不再變化
C.混合氣體的密度不再變化
D.CO2的體積分數不再變化
(3)在T1℃和T2℃時(T1<T2),向恒容容器中投入等物質的量的兩種反應物,發生以下反應:HN=C=O(g)+NH3(g)?CO(NH2)2(g)ΔH<0,平衡時lgp(NH3)與lgp[CO(NH2)2]的關系如圖2Ⅰ所示,p為物質的分壓強(單位為kPa)。
①若v正=k正×p(HNCO)×p(NH3),v逆=k逆×p[CO(NH2)2]。T1℃時,=k正k逆kPa-1。
②T2℃時此反應的標準平衡常數KΘ=。(對于反應:dD(g)+eB(g)?gG(g),KΘ=,其中pΘ=100kPa,p(G)、p(D)、p(E)為各組分的平衡分壓)[p(G)pΘ]g[p(D)pΘ]d[p(E)pΘ]e
③若點A時繼續投入等物質的量的兩種反應物,再次達到平衡時(溫度不變),CO(NH2)2的體積分數(填“變大”“變小”或“不變”)。
④圖2Ⅱ為在不同催化劑下,反應至相同時間容器中尿素的物質的量隨溫度變化的曲線,則在T1℃,催化效率最好的是催化劑(填序號)。T2℃以上,n[CO(NH2)2]下降的原因可能是(答出一點即可,不考慮物質的穩定性)。組卷:41引用:1難度:0.2


