2021-2022學(xué)年吉林省長春十一高高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共20小題,1-10每小題2分,11-20每小題2分。在每小題給出的四個(gè)選項(xiàng)中,只有一個(gè)選項(xiàng)是符合題目要求的。
-
1.用pOH表示溶液的酸堿度,已知pOH=-lgc(OH-),常溫下,0.1mol?L-1的下列溶液中pOH最大的是( )
A.CH3COOH B.NaOH C.HCl D.NH3?H2O 組卷:17引用:1難度:0.7 -
2.下列用于解釋事實(shí)的方程式書寫不正確的是( )
A.向硫代硫酸鈉溶液中加入稀硫酸:S2O32-+2H+═SO2↑+S↓+H2O B.用飽和Na2CO3溶液處理水垢中的CaSO4:Ca2++CO32-═CaCO3↓ C.水是一種極弱的電解質(zhì):H2O?H++OH- D.用明礬[KAl(SO4)2?12H2O]作凈水劑:Al3++3H2O?Al(OH)3(膠體)+3H+ 組卷:8引用:1難度:0.7 -
3.用如圖所示實(shí)驗(yàn)裝置進(jìn)行相應(yīng)的實(shí)驗(yàn),能達(dá)到實(shí)驗(yàn)?zāi)康牡氖牵ā 。?/h2>
A. 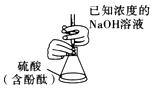
用如圖裝置進(jìn)行已知濃度的NaOH溶液滴定未知濃度的硫酸B. 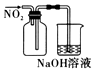
用如圖裝置收集NO2氣體C. 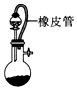
用如圖裝置制備氣體并對生成的氣體體積進(jìn)行測量,可以減少誤差D. 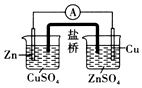
用如圖裝置構(gòu)成銅鋅原電池組卷:10引用:3難度:0.5 -
4.下列有關(guān)反應(yīng)原理的認(rèn)識,正確的是( )
A.鎂條與稀鹽酸的反應(yīng)既屬于氧化還原反應(yīng),又屬于吸熱反應(yīng) B.溫度升高,分子動(dòng)能增加,減小了活化能,故反應(yīng)速率增大 C.選用適當(dāng)?shù)拇呋瘎肿舆\(yùn)動(dòng)加快,增加了碰撞頻率,故反應(yīng)速率增大 D.H+和OH-的反應(yīng)活化能接近于零,反應(yīng)幾乎在瞬間完成 組卷:2引用:1難度:0.7 -
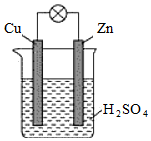 5.有關(guān)如圖所示裝置的敘述中,正確的是( )
5.有關(guān)如圖所示裝置的敘述中,正確的是( )A.該裝置能將電能轉(zhuǎn)變?yōu)榛瘜W(xué)能 B.電子從鋅片經(jīng)硫酸溶液流向銅片 C.當(dāng)有0.2mol電子通過外電路時(shí),鋅片質(zhì)量減輕6.5g D.當(dāng)有0.2mol電子通過外電路時(shí),銅片質(zhì)量增加6.4g 組卷:33引用:5難度:0.5 -
6.下列實(shí)驗(yàn)中,均產(chǎn)生白色沉淀。
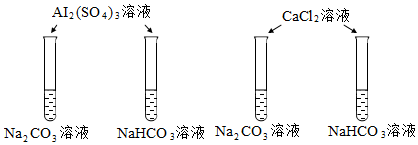
下列分析不正確的是( )A.Na2CO3與NaHCO3溶液中所含微粒種類相同 B.CaCl2能促進(jìn)Na2CO3、NaHCO3水解 C.Al2(SO4)3能促進(jìn)Na2CO3、NaHCO3水解 D.4個(gè)實(shí)驗(yàn)中,溶液滴入后,試管中溶液pH均降低 組卷:725引用:14難度:0.6 -
7.已知:可逆反應(yīng)2SO2(g)+O2(g)?2SO3(g)△H<0。現(xiàn)有甲、乙兩個(gè)體積為VL的真空恒容密閉容器,向甲容器中加入2molSO2(g) 和1molO2(g),在一定條件下發(fā)生反應(yīng),達(dá)到平衡時(shí)放出熱量為Q1kJ,且平衡時(shí)SO3的體積分?jǐn)?shù)為a1。在相同條件下,向乙容器中加入2molSO3(g) 并發(fā)生反應(yīng),達(dá)到平衡時(shí)吸收熱量為Q2kJ,若3Q1=5Q2。下列敘述中正確的是( )
A.達(dá)平衡時(shí)甲、乙中SO2的體積分?jǐn)?shù):乙>甲 B.達(dá)平衡時(shí)甲中SO2的轉(zhuǎn)化率為60% C.乙中反應(yīng)的熱化學(xué)方程式為2SO3(g)?2SO2(g)+O2(g)△H=+Q2kJ/mol D.達(dá)到平衡后,再向甲中加入0.5molSO2(g)、0.25molO2(g),再次平衡后,SO3的體積分?jǐn)?shù)大于a1 組卷:8引用:2難度:0.6 -
8.下列各組物質(zhì)混合后,再加熱蒸干并在300℃時(shí)充分灼燒至質(zhì)量不變,最終一定能得到純凈物的是( )
A.向FeCl2溶液中通入過量Cl2 B.向NaHCO3溶液中加入一定質(zhì)量的Na2O2粉末 C.向KI和NaBr混合溶液中通入過量Cl2 D.向NaOH溶液中加入過量AlCl3溶液 組卷:49引用:2難度:0.5
二、解答題:本題共4小題,共50分.
-
23.孔雀石主要成分是Cu2(OH)2CO3,還含少量FeCO3及硅的氧化物,實(shí)驗(yàn)室以孔雀石為原料制備硫酸銅晶體的步驟如圖:
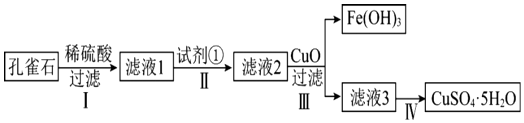
有關(guān)物質(zhì)沉淀的pH數(shù)據(jù)如下:
(1)步驟Ⅰ加稀硫酸充分反應(yīng),提高步驟Ⅰ反應(yīng)速率的措施是物質(zhì) pH(開始沉淀) pH(完全沉淀) Fe(OH)3 1.9 3.2 Fe(OH)2 7.0 9.0 Cu(OH)2 4.7 6.7 (寫一條即可)。
(2)步驟Ⅱ中試劑①應(yīng)選用試劑(填代號)。
a.KMnO4
b.稀HNO3
c.雙氧水
d.氯水
相關(guān)反應(yīng)的離子方程式為:。
(3)步驟Ⅲ加入CuO調(diào)節(jié)溶液的pH至(填寫范圍),目的是。
(4)從濾液3中獲得干燥的硫酸銅晶體的操作是。
(5)常溫下Fe(OH)3 的Ksp═1×10-39,若要將溶液中的Fe3+轉(zhuǎn)化為Fe(OH)3 沉淀,使溶液中c(Fe3+)降低至1×10-3mol/L,必須將溶液調(diào)節(jié)至pH。
(6)用NH3和孔雀石反應(yīng)可以制得金屬銅,已知1mol氨氣通過灼熱的Cu2(OH)2CO3可以產(chǎn)生1.5mol金屬銅,則該反應(yīng)的化學(xué)方程式為。組卷:19引用:1難度:0.5 -
24.可樂中的食品添加劑有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可樂的辛辣味與磷酸(化學(xué)式為H3PO4,沸點(diǎn)高難揮發(fā))有一定關(guān)系。
(1)室溫下,測得0.1mol?L-1H3PO4溶液的pH=1.5,用電離方程式解釋原因:。
(2)羥基磷灰石[Ca5(PO4)3OH]是牙釉質(zhì)的主要成分,在唾液中存在平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq)。長期過量飲用可樂會(huì)破壞牙釉質(zhì),造成齲齒。結(jié)合平衡移動(dòng)原理解釋原因:。
(3)常溫下,向磷酸溶液中滴加NaOH溶液,含磷微粒的分布比例與pH的關(guān)系如圖所示。
①NaH2PO4溶液顯酸性。下列有關(guān)分析正確的是。
a.溶液中c(OH-)>c(H+)
b.H2PO4-的電離程度大于其水解程度
c.c(Na+)+c(H+)═c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH-)
d.溶液中水的電離程度比純水大
②當(dāng)溶液的pH由4到10時(shí),所發(fā)生反應(yīng)的離子方程式是:。
(4)小組同學(xué)在實(shí)驗(yàn)室測定某可樂中磷酸的含量(不考慮白砂糖、咖啡因的影響)。
i.將可樂樣品注入圓底燒瓶,加入活性炭,吸附色素。
ii.將可樂回流加熱10 min,冷卻至室溫,過濾。
iii.取50.00mL濾液,用百里香酚酞作指示劑,用0.100mol?L-1NaOH溶液滴定至終點(diǎn)時(shí)生成Na2HPO4,消耗NaOH溶液5.00mL。
①加熱的目的是。
②該可樂樣品中磷酸的含量為g/L。[M(H3PO4)=98 g/mol]組卷:18引用:3難度:0.6


