2021-2022學年安徽省宿州市十三所重點中學高二(上)期中化學試卷
發布:2024/12/28 19:30:2
一、選擇題(本題共計16小題,每小題只有一個正確答案,每小題3分,共計48分)
-
1.下列關于焓與熵的說法正確的是( )
A.焓與內能無關 B.化學反應的反應熱等于反應的焓變 C.孤立體系(與環境沒有物質交換和能量交換)的自發過程向著熵增方向進行 D.焓與物質的聚集狀態有關,熵與物質的聚集狀態無關 組卷:11引用:1難度:0.5 -
2.下列關于熱化學反應的描述中正確的是( )
A.若鹽酸和NaOH溶液反應生成1molH2O(l)的△H為-57.3kJ?mol-1,則CH3COOH溶液和Ba(OH)2溶液反應生成1molH2O(l)的△H也為-57.3kJ?mol-1 B.CO(g)燃燒熱是283.0kJ?mol-1,則2CO2(g)=2CO(g)+O2(g)的△H=-(2×283.0)kJ?mol-1 C.N2(g)燃燒熱是指在101kPa,1molN2(g)完全生成NO2(g)時所放出的熱量 D.同溫同壓下,4Al(s)+3O2(g)═2Al2O3(s)在常溫和點燃條件下的△H相同 組卷:7引用:1難度:0.8 -
3.下列反應既屬于氧化還原反應,又屬于吸熱反應的是( )
A.NaHCO3與鹽酸的反應 B.灼熱的炭與CO2的反應 C.鎂條與稀鹽酸的反應 D.H2O2的分解反應 組卷:6引用:1難度:0.7 -
4.下列關于化學反應速率說法正確的是( )
A.升高溫度,可以改變反應的活化能,從而加速反應的進行 B.催化劑能改變反應歷程,改變活化分子百分數,從而改變化學反應速率 C.反應物不止一種時,不同反應物的濃度變化對化學反應速率的影響程度一定相同 D.在恒容容器中進行合成氨反應,恒溫時充入He,體系壓強增大,從而加速反應 組卷:17引用:1難度:0.7 -
5.在恒溫恒容密閉容器中,投入一定量X,發生反應:2X(g)?2Y(g)+Z(g),下列敘述中能說明該反應達到平衡狀態的是( )
①單位時間內生成nmolZ的同時消耗2nmol Y;
②Y的濃度不再改變;
③Y與Z的物質的量之比為2:1;
④2v(Y)正=v(Z)逆;
⑤混合氣體的平均相對分子質量不再改變;
⑥容器內密度不再改變A.①②⑤ B.①②③ C.②③⑤ D.②④⑤ 組卷:17引用:4難度:0.6 -
6.在容積為1L恒容容器內進行反應 4A(g)+3B(s)?2C(g)+D(g),經2min后,A的濃度減少了0.8mol?L-1。下列反應速率的表示正確的是( )
A.在這2min內,用單位時間內B的物質的量變化表示的平均反應速率是 0.3mol?min-1 B.2min末時的反應速率,用A表示為0.2mol?L-1?min-1 C.在這2min內,用B表示的平均反應速率是0.3mol?L-1?min-1 D.在這2min內,用A表示的反應速率的值是減小的,用C表示的反應速率逐漸增大 組卷:8引用:1難度:0.6
二、填空題(本大題4小題,共計52分)
-
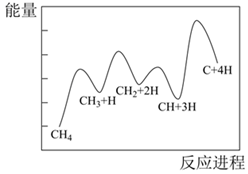 19.化學反應原理包括化學反應的方向、速率、限度、反應歷程等方面。
19.化學反應原理包括化學反應的方向、速率、限度、反應歷程等方面。
(1)請從下面兩個設計的反應中選擇一個回收利用CO2:
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-48.971kJ?mol-1
②CO2(g)+2H2O(g)?CH3OH(l)+O2(g)△H=+676.48kJ?mol-132
假設焓變與熵變不隨溫度變化而改變,你認為反應(填序號)更合適,理由是:;
(2)大多數的化學反應往往是經過多個反應步驟才能實現。
CH4分解形成碳的反應歷程如圖所示。寫出第二步的方程式,若要提升總反應的速率,關鍵是提升第步的速率。
(3)化學平衡常數是描述化學反應限度的依據,其形式有多種,其中一種重要的平衡常數是壓強平衡常數Kp,其計算方法是:將化學平衡常數K表達式中各物質的物質的量濃度換成分壓,分壓=總壓×體積分數。將足量的某碳酸氫鹽(MHCO3)固體置于真空恒容容器中達到平衡:2MHCO3(s)?M2CO3(s)+H2O(g)+CO2(g)
①寫出此反應的壓強平衡常數表達式Kp=;
②若在105℃平衡時體系的總壓為46kPa。保持溫度不變,開始時在體系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡時體系中水蒸氣的分壓等于10kPa,CO2(g)的初始壓強為kPa。組卷:44引用:1難度:0.9 -
20.(1)下列物質均為中學化學常見物質:
①NaCl固體
②乙醇
③氨氣
④銅
⑤BaSO4固體
⑥乙酸
⑦氫氧化銅固體
⑧鹽酸
⑨CH3COONH4 固體
完成關于這些物質的相關問題:
以上物質能導電的是(填序號,下同),
以上物質屬于非電解質是,
屬于強電解質是,
屬于弱電解質的是。
(2)若維持25℃溫度不變,向冰醋酸中加水稀釋,下列表達式的數據一定變小的是。
A.c(H+)
B.c(H+)c(CH3COOH)
C.c(CH3COOH)+c(CH3COO-)
D.n(H+)
(3)現有25℃時2.0mol?L-1的醋酸溶液 (已知25℃時Ka(CH3COOH)=1.8×10-5,=1.414)2
①CH3COOH的電離α≈(α=×100%);已電離的溶質分子數原有溶質的分子總數
②再將其加水稀釋到原體積的2倍,c(H+)≈。(用科學記數法表示)組卷:16引用:1難度:0.7


