2021-2022學年上海市復旦附中高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題只有1個正確選項,每題2分,共40分)
-
1.19世紀末,人類開始揭開原子內部結構的秘密,最先發現電子的科學家是( )
A.法國化學家拉瓦錫 B.英國物理學家湯姆生 C.意大利物理學家阿伏加德羅 D.英國化學家道爾頓 組卷:119引用:11難度:0.9 -
2.下列各組中兩種微粒所含電子數不相等的是( )
A.H3O+和OH- B.CO和N2 C.HNO2和NO2- D.CH3+和NH4+ 組卷:17引用:1難度:0.7 -
3.化學學科需要借助化學專用語言描述。下列有關化學用語錯誤的是( )
A.鎂離子的電子式Mg2+ B.Cl-的結構示意圖 
C.硫化氫的化學式H2S D.質量數為37的氯原子 Cl1737組卷:5引用:1難度:0.7 -
4.我國科學家在世界上第一次為一種名為“鈷酞菁”的分子(直徑為1.3×10-9m)恢復了磁性。“鈷酞菁”分子的結構和性質與植物體內的葉綠素非常相似。下列說法錯誤的是( )
A.此項工作可廣泛應用于光電器件、生物技術等方面 B.“鈷酞菁”分子所形成的分散系具有丁達爾效應 C.此項工作可以用來改變分子的某些物理性質 D.“鈷酞菁”分子既能透過濾紙,也能透過半透膜 組卷:4引用:1難度:0.8 -
5.下列有關說法正確的是( )
A.膠體只能在液體中形成 B.納米材料粒子直徑一般在10-9~10-7m之間,因此納米材料屬于膠體 C.Fe(OH)3膠體電泳的實驗中,陰極附近顏色加深,陽極附近顏色變淺,證明Fe(OH)3膠體帶正電 D.將碳酸鈣經過特殊加工制成納米碳酸鈣,化學性質沒有明顯變化 組卷:32引用:4難度:0.8 -
6.下列物質在水溶液中的電離方程式書寫正確的是( )
A.NaHSO4═Na++H++SO42- B.Ba(OH)2═Ba2++OH- C.H2O═H++OH- D.H2CO3═2H++CO32- 組卷:18引用:3難度:0.7 -
7.溫度和壓強相同時,在體積相同的兩個密閉容器甲和乙。甲中充滿O2氣體,乙中充滿O2和O3的混合氣體,下列說法正確的是( )
A.兩容器中氣體的質量相等 B.兩容器中氣體的分子數目相等 C.兩容器中氣體的氧原子數目相等 D.兩容器中氣體的密度相等 組卷:14引用:1難度:0.6 -
8.清末成書的《化學鑒原》中有一段描述:“各原質(元素)化合所用之數名曰‘分劑數’。養氣(氧氣)以八分為一分劑(即分劑數為八),……一分劑輕氣(氫氣)為一,……并之即水,一分劑為九”。其中與“分劑數”一詞最接近的現代化學概念是( )
A.摩爾質量 B.物質的量 C.化合價 D.質量分數 組卷:99引用:3難度:0.8 -
9.配制100mL 1.0mol?L-1的NaOH溶液時,下列實驗操作會使溶液濃度偏高的是( )
A.稱量時用濾紙盛放氫氧化鈉固體 B.轉移溶液時,發現容量瓶中有水 C.搖勻后,發現液面低于刻度,再補充幾滴水至刻度 D.在容量瓶中定容時俯視刻度線 組卷:8引用:2難度:0.6
三、計算題(15分;需寫出計算過程,無過程不得分)
-
26.液氯儲罐中常混有NCl3,當液氯中NCl3的質量分數達到4%以上就有爆炸危險。為測定氯氣中的NCl3含量,將一定量樣品先通過足量鹽酸吸收NCl3(反應為:NCl3+4HCl=NH4Cl+3Cl2)。再用400mL6.1mol/L的NaOH溶液(ρ=1.22g/cm3)吸收所有的Cl2,測得吸收后NaOH溶液增重56.8g(不考慮鹽酸揮發)。經測定NCl3吸收管內NH4+質量為0.270g。
(1)計算上述NaOH溶液的質量分數。
(2)計算該樣品中NCl3的質量分數,并判斷該樣品是否安全?組卷:13引用:1難度:0.5 -
27.由氫氣和氯氣組成的混合氣體,經光照充分反應后,通入100mL1mol/LNaOH溶液中,溶液中某種離子的物質的量(圖甲)和溶液的導電性(圖乙)隨著反應后的混合氣體通入體積的變化而變化。
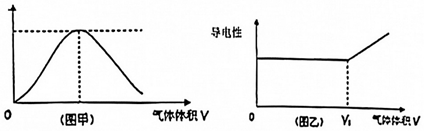
(1)圖甲曲線表示溶液中離子的變化。
(2)對溶液進行導電性實驗時,發現當通入的光照反應后的混合氣體體積大于V1時,隨著混合氣體的通入,溶液導電性明顯增強,引起導電性增強的主要正負離子是。
(3)當圖甲中n=0.01mol時,則光照前的混合氣體中H2和Cl2的物質的量之比為。(書寫必要步驟)組卷:46引用:1難度:0.7


