2023年新疆烏魯木齊高級中學高考化學一模試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共14小題,每小題3分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列是我國科研成果所涉及材料,有關分析正確的是( )
A.“中國天眼”的鋼鐵結構圈梁屬于純金屬材料 B.北京冬奧會聚氨酯速滑服屬于有機高分子材料 C.嫦娥五號發動機使用的鈦合金屬于新型無機非金屬材料 D.我國發射的火星探測器,其太陽能電池板的主要材料是二氧化硅 組卷:76引用:2難度:0.8 -
2.下列解釋實驗事實的化學方程式正確的是( )
A.Na和Cl形成NaCl的過程: 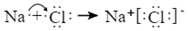
B.用FeCl3溶液“腐蝕”覆銅板:Fe3++Cu═Fe2++Cu2+ C.用石墨電極電解CuCl2溶液:2Cl-+2H+ H2↑+Cl2↑電解D.“84消毒液”中加少量醋增強漂白性:ClO-+H+=HClO 組卷:32引用:2難度:0.7 -
3.依據下列實驗,預測的實驗現象正確的是( )
選項 實驗內容 預測的實驗現象 A MgCl2溶液中滴加NaOH溶液至過量 產生白色沉淀后沉淀消失 B FeCl2溶液中滴加KSCN溶液 溶液變血紅色 C AgI懸濁液中滴加NaCl溶液至過量 黃色沉淀全部轉化為白色沉淀 D 酸性KMnO4溶液中滴加乙醇至過量 溶液紫紅色褪去 A.A B.B C.C D.D 組卷:323引用:7難度:0.6 -
4.NA為阿伏加德羅常數的值。下列說法正確的是( )
A.12gNaHSO4溶于水所得溶液中含陽離子數目為0.1NA B.標準狀況下,22.4LHCl氣體中含非極性鍵數目為NA C.2.0L1.0mol?L-1AlCl3溶液中,Cl-的數目為6.0NA D.0.1molH2和0.1molI2于密閉容器中充分反應后,生成HI分子總數為0.2NA 組卷:80引用:5難度:0.7 -
5.中成藥連花清瘟膠囊可用于流感的防治,其成分之一綠原酸的結構簡式如圖:
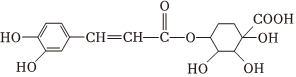
下列關于綠原酸的敘述不正確的是( )A.苯環上的一氯代物有三種 B.1mol該物質最多可與4mol氫氣發生加成反應 C.分子中所有碳原子可能共平面 D.可發生酯化、加成、水解、氧化反應 組卷:439引用:5難度:0.7 -
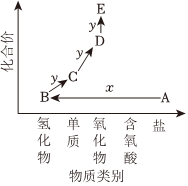 6.如圖是某短周期元素的價類二維圖。其中A為無機鹽,E的相對分子質量比D大16。下列說法不正確的是( )
6.如圖是某短周期元素的價類二維圖。其中A為無機鹽,E的相對分子質量比D大16。下列說法不正確的是( )A.若x為強酸,則物質D可使石蕊溶液先變紅后褪色 B.E與水反應一定能生成一種強酸 C.若x為強堿,則D→E的反應可用于檢驗D D.若x為強堿,則物質A~E中均含有氮元素 組卷:97引用:3難度:0.5
二、非選擇題:共58分
-
19.一種利用電解錳陽極泥(主要成分MnO2、MnO)制備MnO2的工藝流程如下:
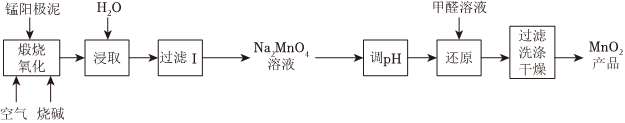
(1)“煅燒氧化”時,1mol MnO煅燒完全轉化為Na2MnO4失去電子的物質的量為;MnO2煅燒反應的化學方程式為。
(2)“浸取”時,為提高Na2MnO4的浸取率,可采取的措施有、(列舉2點)
(3)“調pH”是將溶液pH 調至約為10,防止pH較低時Na2MnO4自身發生氧化還原反應,生成MnO2和;寫出用pH試紙測定溶液pH的操作。
(4)“還原”時有無機含氧酸鹽生成,發生反應的化學方程式為。
(5)測定產品中MnO2質量分數的步驟如下:
步驟1.準確稱取mg產品,加入c1mol?L-1Na2C2O4溶液V1mL (過量)及適量的稀硫酸,水浴加熱煮沸一段時間。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步驟2.然后用c2mol?L-1KMnO4標準溶液滴定剩余的Na2C2O4滴定至終點時消耗KMnO4標準溶液V2mL.(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步驟2達滴定終點時判斷依據是;產品中MnO2的質量分數為ω(MnO2)=(列出計算的表達式即可)。組卷:26引用:2難度:0.5 -
20.實驗小組探究(NH4)2S2O8溶液與KI溶液的反應及其速率,實驗過程和現象如表。已知:
i.(NH4)2S2O8具有強氧化性,能完全電離,S2易被還原為O2-8;SO2-4
ii.淀粉檢測I2的靈敏度很高,遇低濃度的I2即可快速變藍:
iii.可與S2發生反應:2S2O2-3+I2=S4O2-3+2I-。O2-6
(1)實驗1-1的目的是編號 1-1 1-2 實驗操作 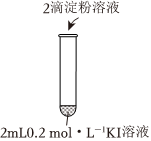
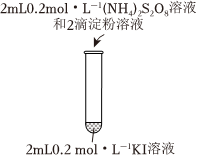
現象 無明顯現象 溶液立即變藍 。
(2)(NH4)2S2O8與KI反應的離子方程式為。
為了研究(NH4)2S2O8與KI反應的速率,小組同學分別向兩支試管中依次加入下列試劑,并記錄變色時間,如表。
(3)實驗2-1不能用于測定(NH4)2S2O8與KI反應的速率,原因除變色時間過短外還有編號 0.2mol?L-1KI溶液/mL 0.01mol?L-1Na2S2O3溶液/mL 蒸餾水/mL 0.4%的淀粉溶液/滴 0.2mol?L-1(NH4)2S2O8溶液/mL 變色時間/s 2-1 2 0 2.8 2 0.2 立即 2-2 2 0.8 0.2 2 2 30 。
(4)加入Na2S2O3溶液后溶液變藍的時間明顯增長,甲同學對此提出兩種猜想。
猜想1:(NH4)2S2O8先與Na2S2O3反應,使c(S2)降低;O2-8
猜想2:(NH4)2S2O8先與KI反應,。
①甲同學提出猜想1的依據:由信息iii推測,Na2S2O3的還原性(填“強于”或“弱于”)KI的。
②乙同學根據現有數據證明猜想1不成立,理由是。
③補全猜想2。
(5)查閱文獻表明猜想2成立。根據實驗2-2的數據,計算30s內的平均反應速率v(S2)=O2-8mol?L-1?s-1(寫出計算式)。組卷:45引用:1難度:0.6


