2022-2023學年北京市鐵路二中高二(上)期中化學試卷
發布:2024/10/30 12:0:3
一、本部分共20題,每題2分,共40分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.下列裝置或過程能實現電能轉化為化學能的是( )
A B C D 



鋅錳干電池 燃氣燃燒 電池充電 水力發電 A.A B.B C.C D.D 組卷:38引用:4難度:0.8 -
2.下列既屬于放熱反應又屬于氧化還原反應的是( )
A.氧化鈣與水反應 B.鐵絲在氧氣中燃燒 C.NaOH溶液與鹽酸反應 D.Ba(OH)2?8H2O晶體與NH4Cl晶體反應 組卷:58引用:6難度:0.6 -
3.一定條件下,在2L密閉容器中發生反應:A(g)+3B(g)═2C(g)+4D(g),測得5min內,A的物質的量減小了10mol,則5min內該反應的化學反應速率是( )
A.υ(A)=1 mol/(L?min) B.υ(B)=1 mol/(L?min) C.υ(C)=1 mol/(L?min) D.υ(D)=1 mol/(L?min) 組卷:253引用:6難度:0.8 -
4.在密閉容器中發生反應:2SO2(g)+O2(g)?2SO3(g),下列情況不能說明反應已達平衡狀態的是( )
A.單位時間內消耗2mol SO2的同時生成1mol O2 B.SO2的轉化率不再變化 C.SO2、O2、SO3的物質的量之比為2:1:2 D.體系的壓強不再變化 組卷:24引用:1難度:0.5 -
5.下列有關:2NO2(g)?N2O4(g)△H<0,平衡體系分析正確的是( )
A.斷裂1molN2O4中的共價鍵所需能量大于斷裂2molNO2中的共價鍵所需能量 B.1mol平衡混合氣體中含2molN原子 C.恒溫時,縮小容積,氣體顏色變深,是平衡正向移動導致的 D.恒容時,水浴加熱,由于平衡正向移動導致氣體顏色變淺 組卷:13引用:1難度:0.5 -
 6.鋅銅原電池裝置如圖,下列說法不正確的是( )
6.鋅銅原電池裝置如圖,下列說法不正確的是( )A.鋅電極上發生氧化反應 B.電子從鋅片經電流計流向銅片 C.銅電極上發生反應:Cu2++2e-═Cu D.一段時間后,取少量右側燒杯中的溶液于試管中,滴加AgNO3溶液,產生白色沉淀 組卷:107引用:1難度:0.5 -
7.用如圖所示裝置可以進行電鍍,下列說法不正確的是( )

A.電鍍時待鍍的金屬制品作陰極,鍍層金屬作陽極 B.用含有鍍層金屬離子的溶液做電鍍液 C.將待鍍鐵件改為粗銅板,即可進行銅的精煉 D.電鍍廢水排放前必須以過處理 組卷:23引用:2難度:0.8 -
8.N2和H2在催化劑表面合成氨的微觀歷程及能量變化的示意圖如下,用
 、
、 、
、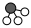 分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g)ΔH=-92kJ?mol-1。下列說法正確的是( )
分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g)ΔH=-92kJ?mol-1。下列說法正確的是( )
A.使用催化劑,合成氨反應正向進行的程度增大 B.②→③過程,是吸熱過程且只有H-H鍵的斷裂 C.③→④過程,N原子和H原子形成了含有非極性鍵的NH3 D.合成氨反應中,反應物斷鍵吸收能量小于生成物形成新鍵釋放的能量 組卷:36引用:1難度:0.8
二、解答題(共6小題,滿分60分)
-
25.近年來,研究人員提出利用含硫物質熱化學循環實現太陽能的轉化與存儲。過程如下:

(1)反應Ⅰ:2H2SO4(l)═2SO2(g)+2H2O(g)+O2(g)△H1=+551kJ?mol-1
反應Ⅲ:S(s)+O2(g)═SO2(g)△H3=-297 kJ?mol-1
反應Ⅱ的熱化學方程式:。
(2)對反應Ⅱ,在某一投料比時,兩種壓強下,H2SO4在平衡體系中物質的量分數隨溫度的變化關系如圖所示。
p2p 1(填“>”或“<”),得出該結論的理由是。
(3)I-可以作為水溶液中SO2歧化反應的催化劑,可能的催化過程如下。將ii補充完整。
i.SO2+4I-+4H+═S↓+2I2+2H2O
ii.I2+2H2O+═++2I-
(4)探究i、ii反應速率與SO2歧化反應速率的關系,實驗如下:分別將18mL SO2飽和溶液加入到2mL下列試劑中,密閉放置觀察現象。(已知:I2易溶解在KI溶液中)
①B是A的對比實驗,則a=A B C D 試劑組成 0.4mol?L-1 KI a mol?L-1 KI
0.2mol?L-1 H2SO40.2mol?L-1 H2SO4 0.2mol?L-1 KI
0000.2mol I2實驗現象 溶液變黃,一段時間后出現渾濁 溶液變黃,出現渾濁較A快 無明顯現象 溶液由棕褐色很快褪色,變成黃色,出現渾濁較A快 。
②比較A、B、C,可得出的結論是。
③實驗表明,SO2的歧化反應速率D>A,結合i、ii反應速率解釋原因:。組卷:61引用:5難度:0.5 -
26.某實驗小組在驗證H2O2氧化Fe2+時發現異常現象,并對其進行了深入探究。
實驗Ⅰ:
(1)實驗Ⅰ中溶液變紅是因為Fe3+與SCN-發生了反應,其離子方程式是裝置與操作 現象 
溶液立即變紅,繼續滴加H2O2溶液,
紅色變淺并逐漸褪去。
(2)探究實驗Ⅰ中紅色褪去的原因:取反應后溶液,(填實驗操作和現象),證明溶液中有Fe3+,而幾乎無SCN-。
(3)研究發現,酸性溶液中H2O2能氧化SCN-,但反應很慢且無明顯現象,而實驗Ⅰ中褪色相對較快,由此推測Fe3+能加快H2O2與SCN-的反應。通過實驗Ⅱ和Ⅲ得到了證實。參照實驗Ⅱ的圖例,在虛線框內補全實驗Ⅲ。
實驗Ⅱ:
實驗Ⅲ:
(4)查閱資料:Fe3+加快H2O2與SCN-反應的主要機理如下:
ⅰ.Fe3++H2O2═Fe2++HO2?+H+
ⅱ.Fe2++H2O2═Fe3++?OH+OH-
ⅲ.?OH(羥基自由基)具有強氧化性,能直接氧化SCN-。
為探究Fe2+對H2O2與SCN-反應速率的影響,設計實驗如下:
實驗Ⅳ:
①t′<t。對比實驗Ⅳ和Ⅱ得出結論:在本實驗條件下,。
②結合資料和(1)~(4)的研究過程,從反應速率和化學平衡的角度解釋實驗Ⅰ中溶液先變紅后褪色的原因:。
③實驗Ⅰ~Ⅳ中均有O2生成,小組同學推測可能是HO2?與溶液中其他微粒相互作用生成的,這些微粒有。組卷:96引用:4難度:0.4


