2021-2022學年湖南省長沙市明德中學高二(上)月考化學試卷(12月份)
發布:2024/11/25 0:0:2
一、單項選擇題(本題包括10小題,每小題3分,共36分。每小題只有一個正確選項。)
-
1.化學與生活、生產、能源、環境和社會可持續發展等密切相關。下列說法正確的是( )
A.廢舊電池屬于有害垃圾,因含有重金屬,故采用深挖填埋的方式進行處理 B.鈣鈦礦太陽能電池和鋰離子電池的工作原理相同 C.工業上常采取電解熔融氯化物制備活潑金屬(如Na、Mg、Al等) D.燃料電池是利用燃料和氧氣反應,將化學能轉化為電能的化學電源 組卷:21引用:6難度:0.7 -
2.下列事實中,不能用勒夏特列原理解釋的是( )
A.工業制取金屬鉀Na(l)+KCl(l)?NaCl(l)+K(g),選取適宜的溫度使K變成蒸氣從反應混合物中分離出來,有利于反應向右進行 B.反應CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,達到平衡后,增大壓強可使平衡體系顏色變深 C.工業上SO2催化氧化生成SO3,常通入過量的空氣來提高SO2的平衡轉化率 D.向含酚酞的Na2CO3溶液中滴加BaCl2溶液,紅色變淺 組卷:7引用:2難度:0.7 -
3.準確取20.00mL某待測HCl溶液于錐形瓶中,用0.1000mol?L-1NaOH溶液滴定,下列說法正確的是( )
A.滴定管用蒸餾水洗滌后,裝入NaOH溶液進行滴定 B.隨著NaOH溶液滴入,錐形瓶中溶液pH由小變大 C.用酚酞作指示劑,當錐形瓶中溶液由紅色變無色時停止滴定 D.滴定終點時,發現滴定管尖嘴部分有懸滴,則測定結果偏小 組卷:726引用:54難度:0.9 -
4.下列事實:
①NaHSO4溶液呈酸性
②長期使用化肥(NH4)2SO4會使土壤酸性增大,發生板結
③配制CuCl2溶液,用稀鹽酸溶解CuCl2固體
④NaHS溶液中c(H2S)>c(S2-)
⑤氯化銨溶液可去除金屬制品表面的銹斑
⑥加熱FeCl3?6H2O晶體,往往得不到FeCl3固體
其中與鹽類的水解有關的敘述有( )A.6項 B.5項 C.3項 D.4項 組卷:29引用:2難度:0.8 -
5.我國研究人員研制出一種新型復合光催化劑,利用太陽光在催化劑表面實現高效分解水,主要過程如圖:

已知: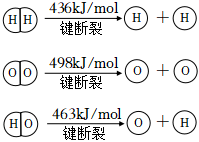
下列說法不正確的是( )A.過程Ⅱ放出能量 B.若分解2molH2O(g),估算出反應吸收482kJ能量 C.催化劑能減小水分解反應的焓變 D.催化劑能降低反應的活化能,增大反應物分子中活化分子的百分數 組卷:28引用:7難度:0.7 -
6.對平衡2SO2(g)+O2(g)?2SO3(g)△H=-198kJ/mol,為提高SO2的轉化率,應采取的合理措施是( )
A.升溫、增壓 B.降溫、減壓 C.升溫、減壓 D.降溫、增壓 組卷:11引用:2難度:0.8
三、非選擇題(本題共4小題,每空2分,共54分。考生根據要求作答。)
-
17.孔雀石主要成分是Cu2(OH)2CO3,還含少量FeCO3及硅的氧化物,實驗室以孔雀石為原料制備硫酸銅晶體的步驟如圖:
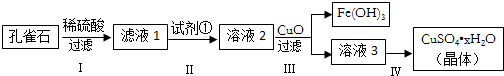
有關物質沉淀的pH數據如表:
(1)步驟Ⅰ加稀硫酸充分反應,過濾得到濾渣的主要成分是物質 pH(開始沉淀) pH(完全沉淀) Fe(OH)3 1.9 3.2 Fe(OH)2 7.0 9.0 Cu(OH)2 4.7 6.7 (填化學式)。
(2)步驟Ⅱ中試劑①應選用試劑(填代號)。
a.KMnO4
b.稀HNO3
c.雙氧水
d.氯水
相關反應的離子方程式為:。
(3)步驟Ⅲ加入CuO調節溶液的pH至3.2≤pH<4.7,目的是。
(4)步驟IV獲得硫酸銅晶體的操作中,必須采取的實驗措施是。
(5)常溫下Fe(OH)3的Ksp=1×10-39,若要將溶液中的Fe3+轉化為Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10-3mol/L,必須將溶液調節至pH=。
(6)用NH3和孔雀石反應可以制得金屬銅,則該反應的化學方程式為。組卷:6引用:1難度:0.6 -
 18.降低能耗是氯堿工業發展的重要方向。
18.降低能耗是氯堿工業發展的重要方向。
(1)我國利用氯堿廠生產的H2作燃料,將氫燃料電站應用于氯堿工業,其示意圖如圖。
①a極為(填“正”或“負”)極。
②乙裝置中電解飽和NaCl溶液的化學方程式為。
③下列說法正確的是。
A.甲裝置可以實現化學能向電能轉化
B.甲裝置中Na+透過陽離子交換膜向a極移動
C.乙裝置中c極一側流出的是淡鹽水
④結合化學用語解釋d極區產生NaOH的原因:。
⑤實際生產中,陽離子交換膜的損傷會造成OH-遷移至陽極區,從而在電解池陽極能檢測到O2,產生O2的電極反應式為。下列生產措施有利于提高Cl2產量、降低陽極O2含量的是。
A.定期檢查并更換陽離子交換膜
B.向陽極區加入適量鹽酸
C.使用Cl-濃度高的精制飽和食鹽水為原料
(2)降低氯堿工業能耗的另一種技術是“氧陰極技術”。通過向陰極區通入O2,避免水電離的H+直接得電子生成H2,降低了電解電壓,電耗明顯減少。“氧陰極技術”的陰極反應為。組卷:80引用:10難度:0.6


