2023-2024學年河北省石家莊四十二中高二(上)第一次月考化學試卷
發布:2024/9/20 19:0:9
一、選擇題:本題共20個小題,每小題3分,共60分。在每小題的四個選項中,只有一項符合題目要求。
-
1.下列一些詩句、成語、諺語等包含的反應過程為反應物總能量比生成物總能量低的是( )
①野火燒不盡,春風吹又生;
②春蠶到死絲方盡,蠟炬成灰淚始干;
③千錘萬鑿出深山,烈火焚燒若等閑;
④爆竹聲中一歲除,春風送暖入屠蘇;
⑤只要功夫深,鐵杵磨成針;
⑥火樹銀花。A.只有③ B.③④⑤ C.⑤⑥ D.①②④⑥ 組卷:22引用:4難度:0.6 -
2.下列關于反應2SO2(g)+O2(g)?2SO3(g)的描述正確的是( )
A.使用催化劑,SO2的平衡轉化率增大 B.增大O2濃度,平衡常數K減小 C.當2v正(SO2)=v逆(O2)時,反應達到平衡狀態 D.降低反應溫度,反應物中活化分子百分數減少,反應速率減慢 組卷:14引用:2難度:0.5 -
3.下列說法正確的是( )
A.放熱反應均是自發反應 B.2CO(g)═2C(s)+O2(g)已知ΔH>0,ΔS<0則一定不能自發進行 C.物質的量增加的反應,ΔS為正值 D.H2、I2、HI平衡混合氣加壓后顏色變深,能用勒夏特列原理解釋 組卷:6引用:2難度:0.5 -
4.已知:一些烷烴的燃燒熱(101kPa時,1mol純物質完全燃燒生成穩定的氧化物時所放出的熱量)如表:
下列說法中正確的是( )化合物 甲烷 乙烷 丙烷 燃燒熱△H/(kJ?mol-1) -891.0 -1560.8 -2221.5 A.C-H鍵的鍵能為 kJ?mol-1891.04B.乙烷燃燒的熱化學方程式為C2H6(g)+ O2(g)=2CO2(g)+3H2O(g)△H=-1560.8kJ?mol-172C.等質量的三種烷烴完全燃燒,丙烷放出的熱量最多 D.由表中數據不能確定C-C鍵的鍵能 組卷:79引用:2難度:0.6 -
5.實驗測得:101kPa時,1molH2完全燃燒生成液態水,放出285.8kJ的熱量;1molCH4完全燃燒生成液態水和CO2,放出890.3 kJ的熱量。下列熱化學方程式書寫正確的是( )
A.2H2(g)+O2(g)═2H2O(l)ΔH=-571.6kJ?mol-1 B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=-890.3kJ C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH=-890.3kJ?mol-1 D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=890.3kJ?mol-1 組卷:256引用:7難度:0.5 -
6.已知在1200℃時,天然氣脫硫工藝中會發生下列反應:
①H2S(g)+O2(g)═SO2(g)+H2O(g) ΔH132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g) ΔH232
③H2S(g)+O2(g)═S(g)+H2O(g) ΔH312
④2S(g)═S2(g) ΔH4
則ΔH4的正確表達式為( )A.ΔH4= (ΔH1+ΔH2-3ΔH3)23B.ΔH4= (3ΔH3-ΔH1-ΔH2)23C.ΔH4= (ΔH1+ΔH2-3ΔH3)32D.ΔH4= (ΔH1-ΔH2-3ΔH3)32組卷:389引用:6難度:0.5 -
7.碘在不同狀態下(固態或氣態)與氫氣反應的熱化學方程式如下所示:
①H2(g)+I2(?)?2HI(g)ΔH1=-9.48kJ?mol-1
②H2(g)+I2(?)?2HI(g)ΔH2=+26.48kJ?mol-1
下列判斷正確的是( )A.①中的I2為固態,②中的I2為氣態 B.1mol固態碘升華時將吸熱17kJ C.①的產物比②的產物熱穩定性更好 D.②中反應物總鍵能比生成物總鍵能大 組卷:71引用:3難度:0.8 -
8.N2O和CO是環境污染性氣體,可在 Pt2O+表面轉化為無害氣體,有關化學反應的物質變化過程及能量變化過程分別如圖甲、乙所示。下列說法不正確的是( )
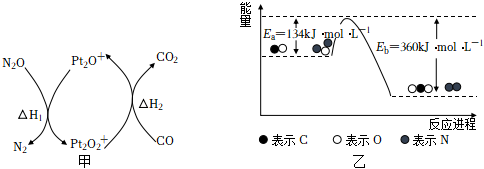
A.總反應的ΔH=ΔH1+ΔH2=-226kJ?mol-1 B.為了實現轉化,需不斷向反應器中補充Pt2O+和Pt2O2+ C.該反應正反應的活化能小于逆反應的活化能 D.CO為還原劑 組卷:22引用:4難度:0.9
二、非選擇題:本題共4個小題,共40分
-
23.Ⅰ.實驗室利用下列方案探究影響化學反應速率的因素.請回答相關問題:
(1)實驗時,分別量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并開始計時,通過測定編號 溫度/℃ H2C2O4溶液 酸性KMnO4溶液 濃度/(mol/L) 體積/mL 濃度/(mol/L) 體積/mL ① 25 0.10 2.0 0.010 4.0 ② 25 0.20 2.0 0.010 4.0 ③ 50 0.20 2.0 0.010 4.0 來判斷反應的快慢.
(2)實驗①、②、③所加H2C2O4溶液均要過量,理由是.
(3)實驗①和實驗②是探究對化學反應速率的影響,實驗②和③是探究對化學反應速率的影響.
(4)實驗①和②起初反應均很慢,過了一會兒速率突然增大,可能原因是.
Ⅱ.在恒容密閉容器中,用H2還原SO2,生成S的反應分兩步完成(如圖1所示),該過程中相關物質的物質的量濃度隨時間的變化關系如圖2所示,請分析并回答如下問題: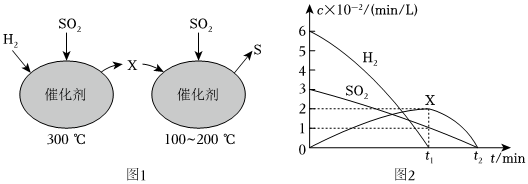
(1)分析可知X為(填化學式).
(2)0~t1時間段的溫度為.
(3)0~t1時間段用SO2表示的化學反應速率為.組卷:10引用:3難度:0.5 -
24.如圖是煤的綜合利用過程中化工產業鏈的一部分:

(1)煤的氣化發生的主要反應是:C(s)+H2O(g)?CO(g)+H2(g)。
已知:C(s)+O2(g)=CO2(g)ΔH=-393kJ?mol-1
H2(g)+O2(g)=H2O(g)ΔH=-242.0kJ?mol-112
CO(g)+O2(g)=CO2(g)ΔH=-283.0kJ?mol-112
煤氣化時發生主要反應的熱化學方程式是:C(s)+H2O(g)?CO(g)+H2(g)
ΔH=kJ/mol
(2)用煤氣化后得到的H2合成氨:N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1。在容積為2L的密閉容器中投入N2和H2充分反應,在不同時間改變反應條件,正反應速率的變化如圖所示。下列說法正確的是(填字母)。
a.t1時可能增大了N2的濃度
b.t2時可能充入了氦氣
c.t3時可能降低了溫度
d.t4時可能分離出氨氣
(3)某溫度時合成甲醇的反應CO(g)+2H2(g)?CH3OH(g)ΔH=-90.8kJ?mol-1,在容積固定的密閉容器中,各物質的濃度如下表所示:
①前2min的反應速率v(H2)=濃度
時間c(CO)/mol?L-1 c(H2)/mol?L-1 c(CH3OH)/mol?L-1 0 1.0 1.8 0 2min 0.5 0.5 4min 0.4 0.6 0.6 6min 0.4 0.6 0.6 。
②該溫度下的平衡常數。(可用分數表示)組卷:2引用:1難度:0.6


