2022-2023學年安徽省六安一中高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(每小題3分,共36分,在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.我們生活在千變萬化的物質世界里。下列變化中,沒有發生氧化還原反應的是( )
A. 
爆竹爆炸B. 
木炭燃燒C. 
鋼水澆鑄D. 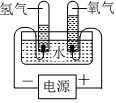
電解水組卷:3引用:6難度:0.8 -
2.下列分散系最不穩定的是( )
A.向氫氧化鈉溶液中通入二氧化碳得到的無色液體 B.向碘水中滴加四氯化碳充分振蕩后,靜置后的下層液體 C.向沸水中滴入氯化鐵飽和溶液得到的紅褐色液體 D.向硫酸銅溶液中加入氫氧化鈉溶液得到的分散系 組卷:11引用:1難度:0.9 -
3.下列敘述正確的是( )
①Na2O與Na2O2都能和水反應生成堿,它們都是堿性氧化物
②Na與CuSO4溶液反應,可置換出單質Cu
③Na在常溫下不容易被氧化
④Na2O2可作供氧劑,而Na2O不行
⑤向石蕊溶液中加入Na2O2粉末,溶液先變藍后褪色,并有氣泡生成
⑥Na與NH4Cl濃溶液反應,放出的氣體中含H2和NH3
⑦膠體區別于其他分散系的本質特征是能產生丁達爾效應A.都正確 B.②③④⑤ C.④⑤⑥ D.②⑤⑥⑦ 組卷:14引用:3難度:0.7 -
4.以下各組離子能在溶液中大量共存的是( )
A.含有大量SO42-的溶液:加入Mg2+、Cu2+、Cl-、NO3- B.滴加酚酞變紅的溶液:加入SO42-、Cu2+、K+、Cl- C.常溫下,加入鐵粉能生成H2的溶液:加入Na+、Ca2+、Cl-、CO32- D.所含溶質為NaHSO4的溶液:加入K+、Fe2+、NO3-、Na+ 組卷:39引用:5難度:0.5 -
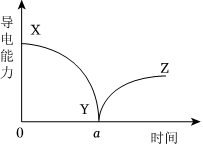 5.某興趣小組向一定體積的Ba(OH)2溶液中逐滴加入稀H2SO4,通過儀器測得混合溶液的導電能力隨時間變化的曲線如圖所示。下列有關說法錯誤的是( )
5.某興趣小組向一定體積的Ba(OH)2溶液中逐滴加入稀H2SO4,通過儀器測得混合溶液的導電能力隨時間變化的曲線如圖所示。下列有關說法錯誤的是( )A.XY段混合溶液的導電能力逐漸減弱,是因為溶液中離子數目減少 B.a時刻,混合溶液中Ba(OH)2與H2SO4,恰好完全反應 C.向一定體積的AgNO3溶液中逐滴加入稀鹽酸,測得的曲線形狀是一樣的 D.該實驗發生反應的離子方程式為2H++ +Ba2++2OH-=BaSO4↓+2H2OSO2-4組卷:24引用:2難度:0.5 -
6.下列離子方程式書寫正確的是( )
A.氫氧化鈣溶液中通入過量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O B.將銅片插入到稀H2SO4溶液中:Cu+2H+=Cu2++H2↑ C.酸性KMnO4溶液中滴加FeSO4溶液:4H2O+5Fe2++MnO4-=5Fe3++Mn2++8OH- D.NaHSO4和Ba(OH)2溶液反應至SO42-恰好沉淀:Ba2++OH-+H++SO42-=BaSO4↓+H2O 組卷:16引用:1難度:0.7 -
7.亞磷酸(H3PO3)是一種弱酸,其受熱分解的方程式為:4H3PO3
3H3PO4+PH3↑。下列說法正確的是( )△A.H3PO3在水溶液中的電離方程式為H3PO3=3H++PO33- B.H3PO3在反應中既作氧化劑被氧化,又作還原劑被還原 C.亞磷酸受熱分解的過程中,被氧化的亞磷酸和被還原的亞磷酸分子個數比為1:3 D.每生成一個PH3分子,轉移6個電子 組卷:8引用:1難度:0.8
三、非選擇題(共48分)
-
20.某課外活動小組設計了下列裝置,驗證二氧化碳跟過氧化鈉反應時是否需要與水接觸。
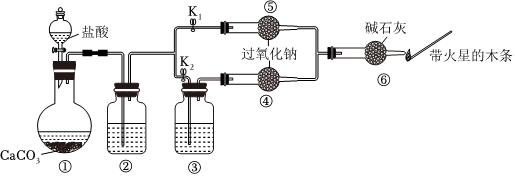
【裝置分析】
(1)已知鹽酸具有揮發性。裝置②中的試劑是飽和NaHCO3溶液,裝置②的作用是。
(2)裝置③中的試劑是濃硫酸,作用是。
【進行實驗】
步驟1:打開彈簧夾K2,關閉K1,打開分液漏斗活塞加入鹽酸,將帶火星的木條放在如圖所示處。
步驟2:打開彈簧夾K1,關閉K2,打開分液漏斗活塞加入鹽酸,將帶火星的木條放在如圖所示處。
(3)步驟1和步驟2中,帶火星的木條產生的實驗現象分別是無明顯現象、帶火星木條復燃。這說明。
(4)請寫出過氧化鈉跟二氧化碳反應的化學方程式并用雙線橋標出電子轉移:。組卷:6引用:1難度:0.5 -
21.某白色粉末中可能含有BaCl2、Na2CO3、K2SO3、CuSO4,現進行以下實驗:
ⅰ.將部分白色粉末加入水中,溶液呈無色,充分振蕩,有白色沉淀生成;
ⅱ.取部分ⅰ中懸濁液,過濾,向得到的固體中加入過量的稀硝酸,白色沉淀部分消失,并有氣體產生。
已知:BaSO3遇到稀硝酸會有氣泡產生且沉淀不消失。
回答下列問題:
(1)由實驗可知:該白色粉末中一定無(填化學式)。
(2)查閱資料可知:BaSO3+HNO3=BaSO4+NO↑+H2O(未配平)。
①請配平該反應的化學方程式:BaSO3+HNO3=BaSO4+NO↑+H2O。
②每生成2個NO,該反應中氧化劑與還原劑的個數之比為(化成最簡比)。
(3)由實驗ⅱ和第(2)問可知:該白色粉末中一定有(填化學式,下同),產生的氣體為。組卷:9引用:1難度:0.6


