2020-2021學年福建省福州三中高二(上)期末化學試卷
發布:2025/1/6 5:0:2
一、選擇題(本大題共14小題,每小題只有一個選項符合題意。共計56分)
-
1.把純凈的甲烷與氯氣的混合氣放在集氣瓶中,用玻璃片蓋好瓶口,放在光亮的地方一段時間后,下列說法中,不正確的是( )
A.與酯化反應是同類型反應 B.瓶內氣體的顏色等變淺 C.用一根蘸有濃氨水的玻璃棒伸入瓶內時無白煙產生 D.集氣瓶壁有油狀液體生成 組卷:15引用:1難度:0.6 -
2.下列物質中,既能因發生化學反應使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②CH3CH2CH═CH2 ③ ④CH3CH3.
④CH3CH3.A.①②③④ B.③④ C.①②④ D.①② 組卷:70引用:11難度:0.7 -
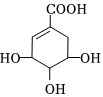 3.莽草酸可用于合成藥物達菲,其結構簡式如圖,下列關于莽草酸的說法正確的是( )
3.莽草酸可用于合成藥物達菲,其結構簡式如圖,下列關于莽草酸的說法正確的是( )A.在水溶液羧基和羥基均易電離出H+ B.可發生加成且不能發生取代反應 C.分子中含有2種官能團 D.分子式為C7H10O5 組卷:3引用:1難度:0.5 -
4.Mg還原SiCl4生成Si的反應如下:
①SiCl4(g)+2Mg(l)?Si(s)+2MgCl2(g)△H1
②SiCl4(g)+2Mg(g)?Si(s)+2MgCl2(g)△H2
下列說法正確的是( )A.Mg(l)=Mg(g)△H═ (△H1-△H2)12B.硅太陽能電池是將化學能轉化為電能 C.減少Mg(l)的量,△H1變小 D.△H1<△H2 組卷:14引用:1難度:0.6 -
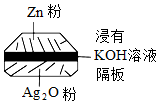 5.微型紐扣電池在現代生活中有廣泛應用。有一種銀鋅電池,其電極分別是Ag2O和Zn,電解質溶液為KOH溶液,總反應方程式為:Zn+Ag2O═ZnO+2Ag,其中一個電極反應為:Zn+2OH--2e-═ZnO+H2O;下列敘述正確的是( )
5.微型紐扣電池在現代生活中有廣泛應用。有一種銀鋅電池,其電極分別是Ag2O和Zn,電解質溶液為KOH溶液,總反應方程式為:Zn+Ag2O═ZnO+2Ag,其中一個電極反應為:Zn+2OH--2e-═ZnO+H2O;下列敘述正確的是( )A.在使用過程中,電解質KOH被不斷消耗 B.Zn是正極,Ag2O是負極 C.每轉移2mol e-,有232g Ag2O被還原 D.使用過程中,電子由Ag2O極經外電路流向Zn極 組卷:23引用:2難度:0.7 -
6.氯堿工業的基本原理就是電解飽和食鹽水。下列關于實驗室電解飽和食鹽水的說法中正確的是( )
A.可以選用石墨棒作為陰、陽極材料,但陽極材料也可以用鐵棒 B.用濕潤的淀粉KI試紙靠近陰極區域,試紙變藍 C.電解過程中,在陽極區域溶液中滴加品紅,品紅褪色 D.實驗結束后,將溶液攪拌,然后用pH試紙檢驗,溶液呈中性 組卷:27引用:3難度:0.7
二、非選擇題(4小題,共44分)
-
18.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用毒重石制備BaCl2?2H2O的流程如圖。
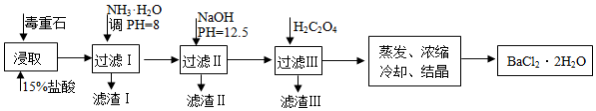
(1)寫出“浸取”環節發生的主要離子方程式.實驗室用37%的鹽酸配制15%的鹽酸,除量筒外還需使用下列儀器中的(雙選,填選項字母)。
a.燒杯
b.容量瓶
c.滴定管
d.玻璃棒
(2)圖是一些難溶氫氧化物在不同pH下的沉淀一溶解圖。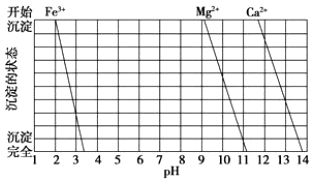
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,
①濾渣Ⅰ中含(填化學式)。再加入NaOH調節pH=12.5可除去(填離子符號)。
②加入H2C2O4應避免過量的原因是。
(3)25℃,H2C2O4的電離平衡常數如下:
①HC2O4-的電離平衡常數表達式 Ka2=H2C2O4 Ka1=5.36×10-2 Ka2=5.35×10-5 。
②NaHC2O4溶液呈(酸性、堿性、中性)。組卷:5引用:2難度:0.5 -
19.研究發現,NOx和SO2是霧霾的主要成分。
Ⅰ.NOx主要來源于汽車尾氣,可以利用化學方法將二者轉化為無毒無害的物質。
已知:N2(g)+O2(g)═2NO(g)△H=+180kJ?mol-1
2CO(g)+O2(g)═2CO2(g)△H=-564kJ?mol-1
(1)2NO(g)+2CO(g)2CO2(g)+N2(g)△H=催化劑,該反應在下能自發進行。(填“高溫”、“低溫”或“任意溫度”)
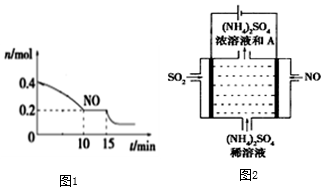
(2)T℃時,將等物質的量的NO和CO充入容積為2L的密閉容器中,保持溫度和體積不變,反應過程(0~15min)中NO的物質的量隨時間變化如圖1所示。
①計算達到平衡時v(N2)=,該反應的平衡常數表達式為平衡后,若保持溫度不變,再向容器中充入NO和CO2各0.3mol,平衡將(填“向左”、“向右”或“不”)移動。
②15min時,若改變外界反應條件,導致n(NO)發生如圖1所示的變化,則改變的條件可能是。(填字母)
A.增大CO濃度
B.升溫
C.減小容器體積
D.加入催化劑
Ⅱ.SO2主要來源于煤的燃燒。燃燒煙氣的脫硫減排是減少大氣中含硫化合物污染的關鍵。
已知:亞硫酸:Ka1=2.0×10-2Ka2=6.0×10-7
(3)請通過計算證明,NaHSO3溶液顯酸性的原因:
(4)如圖2所示的電解裝置,酸性條件下,可將霧霾中的NO、SO2轉化為硫酸銨,從而實現廢氣的回收再利用。通入NO的電極反應式為;若通入的NO體積為4.48L(標況下),則另外一個電極通入的SO2質量至少為g。組卷:15引用:2難度:0.5


