2023年江蘇省揚州市廣陵區中考化學二模試卷
發布:2024/6/18 8:0:10
一、選擇題:本題包括20小題,每小題2分,共40分。每小題只有一個選項符合題意
-
1.中國政府向世界宣布2030年前實現碳達峰,2060年前實現碳中和。下列做法不利于實現“碳達峰、碳中和”的是( )
A.綠色出行 B.火力發電 C.植樹造林 D.節約用電 組卷:297引用:23難度:0.7 -
2.高鐵車廂內禁止吸煙須張貼的標志是( )
A. 
B. 
C. 
D.  組卷:21引用:2難度:0.8
組卷:21引用:2難度:0.8 -
3.生活中下列物質加入適量水不能形成溶液的是( )
A.食醋 B.食用油 C.白砂糖 D.食鹽 組卷:86引用:7難度:0.7 -
4.屬于氧化物的是( )
A.O2 B.CO2 C.NaOH D.Na2CO3 組卷:32引用:4難度:0.9 -
5.水是生命之源,下列關于水的說法正確的是( )
A.過濾可以除去水中所有雜質 B.工業廢水未經處理直接排放 C.硬水煮沸后可轉化成軟水 D.電解水實驗證明水由H2、O2組成 組卷:25引用:4難度:0.6 -
6.化學用語是學習化學的重要工具。下列表示正確的是( )
A.氯元素:CL B.硫酸根離子: SO2-3C.氧化鋁AlO D.兩個氫分子:2H2 組卷:146引用:6難度:0.8 -
7.下列物質是由分子構成的是( )
A.酒精 B.鋁 C.金剛石 D.氯化鉀 組卷:9引用:3難度:0.6 -
8.載人航天器中處理CO2的一種方法為2Li2O2+2CO2═2X+O2,X的化學式為( )
A.Li B.Li2O C.Li2CO3 D.LiOH 組卷:868引用:38難度:0.5
非選擇題
-
24.氫氣被視為未來理想的能源,科學家對氫的研究從未停歇。氫能源的廣泛使用需解決制氫、儲氫等問題。
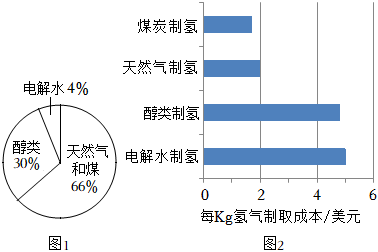
Ⅰ.圖1、圖2分別為全球制氫原料占比和主流制氫方法的經濟性對比圖。
(1)由圖象可知:目前氫氣的主要來源是(填“天然氣和煤”、“醇類”或“水”)。
(2)結合圖2分析,目前電解水制氫還不適宜大規模推廣的可能原因是。
(3)電解水制氫需要消耗大量電能,下列獲取電能的方式中,一定存在碳排放的是(填字母)。
A.水力發電
B.太陽能發電
C.燃煤發電
(4)甲烷和水蒸氣催化重整是制高純氫的重要方法之一,生產過程中涉及的重要反應有:
a.CH4+H2OCO+3H2,b.CO+H2O催化劑△CO2+H2催化劑
①通過調控反應條件。使a中生成的CO在b中全部轉化,目的是。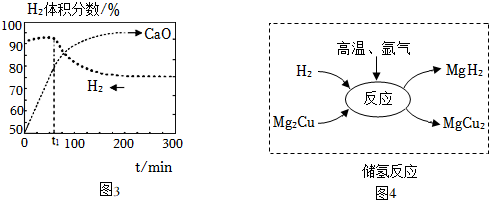
②催化重整體系中還需要投入一定量的CaO用來吸收,提高H2的體積分數。H2體積分數和CaO消耗率隨時間變化關系如圖3,從t1起,單位時間內CaO消耗率(填“升高”“降低”或“不變”)。
Ⅱ.氫氣的儲存有以下兩種方式。
(5)方法一:將氫氣直接加壓儲存在由某種鎂鋁合金制造的儲氫罐中備用。從物質分類的角度來看,鎂鋁合金屬于(填“純凈物”或“混合物”)。
(6)方法二:先通過Mg、Cu與氫氣反應,將氫氣轉化為MgH2暫時“儲存”起來,此為儲氫反應(如圖5)。化合物MgH2中的鎂元素化合價為+2價,氫元素的化合價為。儲氫反應的化學方程式為。需要使用氫氣時,可通過釋氫反應實現:MgH2+2H2O=Mg(OH)2+2H2↑。13克MgH2全部與水反應,釋放出H2的質量為克。組卷:140引用:3難度:0.6 -
25.碳酸鋰(Li2CO3)是制備鋰電池的重要原料,工業上可通過以下兩種途徑制備。
方案一:以鋰輝石精礦(主要成分為Li2O,其余成分不溶于水,也不參與反應)為原料制取碳酸鋰粗產品,其主要工藝流程如圖所示: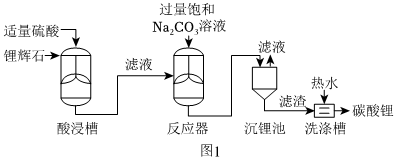
查閱資料:①碳酸鋰的溶解度與溫度的關系見下表:
②碳酸鋰與碳酸鈣類似,能與酸發生復分解反應。溫度/℃ 0 20 40 60 80 100 溶解度/g 1.54 1.33 1.17 1.01 0.85 0.72
(1)在投入酸浸槽前,鋰輝石精礦需進行粉碎研磨的預處理,其目的是。
(2)酸浸槽中發生的反應的化學方程式為。
(3)沉鋰池中分離Li2CO3的操作名稱是。
(4)洗滌時使用熱水的原因是。
(5)驗證Li2CO3洗滌干凈的操作是,取最后一次洗滌液,向其中加入溶液,無明顯現象,則Li2CO3洗滌干凈。
方案二:利用廢舊磷酸鐵鋰電池采用“過氧化氫+硫酸”浸出體系,在外加電場作用下使鋰離子脫出,選擇性回收鋰。浸出液經過除雜后再加入過量的碳酸鈉溶液可獲得粗碳酸鋰。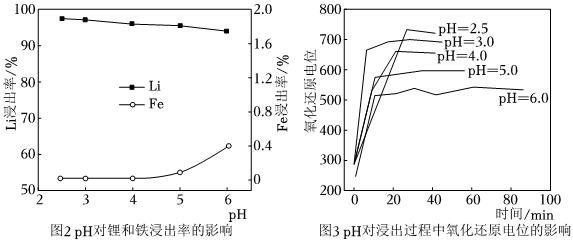
(6)浸出過程保持更高的氧化還原電位,可以更好地促進鋰的浸出,抑制鐵的溶解,從而更好地實現了鋰的選擇性浸出。綜合圖2、圖3,該過程選擇最適宜的pH范圍是(填字母)。
A.2.5-3.0
B.3.0-4.0
C.5.0-6.0
(7)方案二利用廢舊磷酸鐵鋰電池制備粗碳酸鋰,其顯著的優點是。(答一點)
測定碳酸鋰粗產品的純度
為測定碳酸鋰粗產品純度(雜質不溶于水,也不參與反應),設計如下實驗裝置。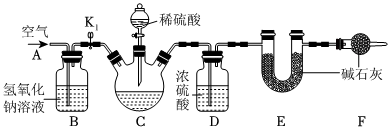
【查閱資料】堿石灰主要成分是氧化鈣和氫氧化鈉固體,能吸收水和二氧化碳。
【操作步驟】
①連接好裝置,檢查裝置的氣密性。
②在C中加入8g碳酸鋰粗產品。打開彈簧夾K1,在A處緩緩通入一段時間的空氣。
③稱量E的質量為342.5g。
④關閉彈簧夾K1,慢慢滴加稀硫酸至過量,直至C中。
⑤再次稱量E的質量為346.9g。
試回答下列問題:
(8)請將步驟④補充完整。
(9)B裝置的作用是。
(10)下列各項措施中,能提高測定準確度的是(填字母)。
A.緩慢滴加稀硫酸
B.在B、C之間增加裝有濃硫酸的洗氣瓶
C.將D、E裝置調換順序
D.去除F裝置
E.在步驟⑤之前,再次打開彈簧夾K1,在A處緩緩通入一段時間的空氣
(11)根據實驗數據,計算碳酸鋰粗產品的純度。(寫出計算過程)組卷:240引用:3難度:0.3


