2021-2022學年天津外國語大學附屬外國語學校高二(上)期末化學試卷
發布:2024/12/31 20:0:3
一、選擇題(本題共15道小題,每題3分,共45分)
-
1.下列物質屬于強電解質,且水溶液呈酸性的是( )
A.SO2 B.NaCl C.NH4Cl D.CH3COONa 組卷:28引用:3難度:0.6 -
2.下列事實能用勒夏特列原理解釋的是( )
A.用犧牲陽極法保護船舶的外殼 B.把食品存放在冰箱里可延長保質期 C.合成氨工業中使用鐵觸媒作催化劑 D.配制FeCl3溶液,常將FeCl3晶體溶于較濃的鹽酸中 組卷:37引用:3難度:0.7 -
3.下列說法不正確的是( )
A.增大反應物濃度,活化分子百分數增大,有效碰撞次數增多 B.增大壓強,單位體積內氣體的活化分子數增多,有效碰撞次數增多 C.升高溫度,活化分子百分數增加,分子運動速度加快,有效碰撞次數增多 D.催化劑能降低反應的活化能,提高活化分子百分數,有效碰撞次數增多 組卷:378引用:21難度:0.9 -
4.下列各組元素中,電負性依次減小的是( )
A.F、N、O B.Cl、C、F C.As、N、H D.Cl、S、As 組卷:80引用:2難度:0.6 -
5.2021年10月,神舟十三號載人飛船成功發射。載人飛船中通過如下過程實現O2再生:
①CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH1=-252.9kJ?mol-1
②2H2O(1)=2H2(g)+O2(g)ΔH2=+571.6kJ?mol-1
下列說法錯誤的是( )A.H2的燃燒熱ΔH=-285.8kJ?mol-1 B.反應2H2(g)+O2(g)=2H2O(g)的ΔH<-571.6kJ?mol-1 C.反應2H2(g)+O2(g)=2H2O(l)常溫下能自發進行 D.反應CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=-890.3kJ?mol-1 組卷:64引用:5難度:0.5 -
6.在恒溫恒容的密閉容器中,發生可逆反應2SO2(g)+O2(g)?2SO3(g),不能說明該反應已經達到平衡狀態的是( )
A.混合氣體的平均摩爾質量保持不變 B.體系的壓強保持不變 C.v消耗(SO2)=v消耗(SO3) D.混合氣體的密度保持不變 組卷:34引用:3難度:0.7
二、非選擇題(共4道題,共55分)
-
18.依據如圖所示三套實驗裝置,分別回答下列問題。
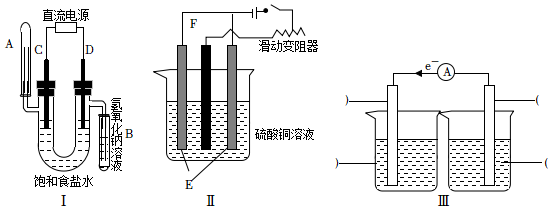
(1)裝置Ⅰ的實驗目的是用惰性電極電解飽和食鹽水,C電極連接電源的極,B管吸收的氣體是,電解食鹽水總反應的離子方程式為。
(2)裝置Ⅱ的實驗目的是在鐵棒上鍍銅,鐵棒為(填“E”或“F”)。另一電極用于及時補充消耗的鍍層物質,結合化學用語說明其原理:。
(3)裝置Ⅲ利用Fe3+與Cu發生的反應,設計一個可正常工作的電池,補全該電化學裝置示意圖,寫出電池工作一段時間后的現象。供選擇的實驗用品:
KCl溶液,FeCl2溶液,
FeCl3溶液,CuSO4 溶液,
銅棒,鋅棒,鐵棒,
石墨棒,氯化鉀鹽橋。組卷:42引用:2難度:0.6 -
 19.科研人員用以下方法測定高爐渣中金屬Fe的含量。
19.科研人員用以下方法測定高爐渣中金屬Fe的含量。
i.配制金屬Fe浸取液。
ii.取mg粉碎后的高爐渣,加入足量金屬Fe浸取液,室溫下浸取1h。
iii.過濾,將濾液及洗滌液全部轉移至盛有過量H2O2溶液的燒杯中,加入鹽酸、稀硫酸充分反應。
iv.將反應后的溶液煮沸至冒大氣泡并繼續微沸10min。
v.冷卻,用濃度為cmol?L-1的抗壞血酸(C6H8O6)標準溶液滴定,消耗抗壞血酸標準溶液VmL[已知:C6H8O6(抗壞血酸)+2Fe3+=C6H6O6(脫氫抗壞血酸)+2Fe2++2H+]。
(1)金屬Fe浸取液配制方法:取一定量亞硫酸鈉和鄰菲羅啉(用于抑制Fe2+的水解)溶于水后,加入乙酸調節pH約為4,再加入一定量乙酸-乙酸銨溶液(pH=4.5),配成所需溶液(在此pH條件下,高爐渣中其他成分不溶解)。
①Fe2+水解的方程式為。
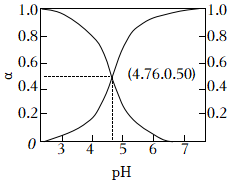
②常溫下,改變乙酸溶液的pH,溶液中CH3COOH、CH3COO-的物質的量分數a(X)隨pH的變化如右圖所示,下列說法正確的是(填字母序號)。
已知:α(X)=n(X)n(CH3COOH)+n(CH3COO-)
a.常溫下,乙酸的電離常數Ka(CH3COOH)=10-4.76
b.pH=4時,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
c.pH=4.5的乙酸-乙酸銨溶液中,c(CH3COO-)+c(OH-)-c(H+)+c(NH4+)
d.向乙酸-乙酸銨溶液中加入少量酸時,溶液中的CH3COO-結合H+,使溶液中的c(H+)變化不大,溶液的pH變化不大
(2)步驟iii中加入過量H2O2溶液,可除去過量的SO32-,另一主要作用是(用離子方程式表示)。
(3)該高爐渣中金屬Fe的質量分數ω(Fe)=(用有關字母的代數式表示)。
(4)若未進行步驟iv,直接用抗壞血酸標準溶液滴定,則會使高爐渣中金屬Fe的質量分數ω(Fe)
(填“偏大”、“偏小”或“無影響”),理由是。組卷:35引用:4難度:0.5


