2021-2022學年安徽師大附中高二(上)期中化學試卷
發布:2024/11/24 0:0:2
一、選擇題:(本題有18小題,共54分。在每小題給出的四個選項中,只有一個選項符合題目要求)
-
 1.理論研究表明,在101kPa和298K下,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示。下列說法錯誤的是( )
1.理論研究表明,在101kPa和298K下,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示。下列說法錯誤的是( )A.HCN比HNC穩定 B.該異構化反應的ΔH=+59.3kJ?mol-1 C.使用催化劑,可以改變反應的反應熱 D.正反應的活化能大于逆反應的活化能 組卷:376引用:18難度:0.5 -
2.下列關于熱化學反應的描述中正確的是( )
A.HCl和NaOH反應的中和熱△H=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3)kJ/mol B.CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的△H=+(2×283.0)kJ/mol C.需要加熱才能發生的反應一定是吸熱反應 D.1mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱 組卷:90引用:8難度:0.5 -
3.我國科研人員提出了由CO2和CH4轉化為高附加值產品CH3COOH的催化反應歷程,該歷程示意圖如圖所示。
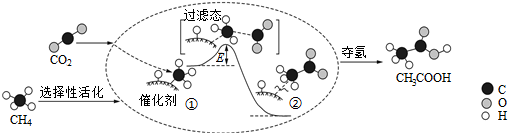
下列說法不正確的是( )A.生成CH3COOH總反應的原子利用率為100% B.CH4→CH3COOH過程中,有C-H鍵發生斷裂 C.①→②放出能量并形成了C-C鍵 D.該催化劑可有效提高反應物的平衡轉化率 組卷:134引用:36難度:0.7 -
4.室溫下,對于1L 0.1mol?L-1醋酸溶液。下列判斷正確的是( )
A.該溶液中CH3COO-的粒子數為6.02×1022 B.加入少量CH3COONa固體后,溶液的pH降低 C.滴加NaOH溶液過程中,n(CH3COO-)與n(CH3COOH)之和始終為0.1mol D.與Na2CO3溶液反應的離子方程式為CO32-+2H+═H2O+CO2↑ 組卷:835引用:9難度:0.7 -
5.下列有關電解質溶液的說法正確的是( )
A.向0.1mol?L-1CH3COOH溶液中加入少量水,溶液中 增大c(CH3COO-)c(CH3COOH)c(OH-)B.將CH3COONa溶液從20℃升溫至30℃,溶液中 減小c(CH3COO-)c(CH3COOH)c(OH-)C.向鹽酸中加入氨水至中性,溶液中 >1c(NH+4)c(Cl-)D.室溫時2.0×10-7mol?L-1的鹽酸中c(H+)=2.0×10-7mol?L-1 組卷:30引用:3難度:0.5 -
6.已知溫度 T 時水的離子積常數為 Kw,該溫度下,將濃度為 amol/L 的一元酸HA 與 bmol/L 的一元堿 BOH 等體積混合,可判斷該溶液呈中性的依據是( )
A.a=b B.混合溶液的 pH 值為 7 C.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) D.混合溶液中C(H+)= mol?L-1Kw組卷:88引用:5難度:0.7 -
7.準確取20.00mL某待測HCl溶液于錐形瓶中,用0.1000mol?L-1NaOH溶液滴定,下列說法正確的是( )
A.滴定管用蒸餾水洗滌后,裝入NaOH溶液進行滴定 B.隨著NaOH溶液滴入,錐形瓶中溶液pH由小變大 C.用酚酞作指示劑,當錐形瓶中溶液由紅色變無色時停止滴定 D.滴定終點時,發現滴定管尖嘴部分有懸滴,則測定結果偏小 組卷:725引用:54難度:0.9
二、非選擇題:(本題有4小題,共46分)
-
22.研究氮及其化合物的轉化對于環境改善有重大意義。
已知N2(g)+O2(g)═2NO(g)ΔH=+180.4kJ/mol,4NH3(g)+5O2(g)═4NO(g)+6H2O(l)ΔH=-905.8kJ/mol。
(1)用NH3消除NO污染的反應為:4NH3(g)+6NO(g)?5N2(g)+6H2O(l),則該反應自發進行的條件是(填“高溫”或“低溫”)。
(2)不同溫度條件下,NH3與NO的物質的量之比分別為4:1、3:1、1:3,得到NO脫除率曲線如圖1所示。曲線a中NH3的起始濃度為4×10-5mol/L,從A點到B點經過2秒,該時間段內NO的脫除速率為mg/(L?s),在AB所在的曲線上當溫度高于900℃時NO脫除率明顯降低的原因是。
(3)工業煙氣中的氮氧化物用NH3催化還原,發生反應:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH<0,研究表明不同氨氮比[m=]條件下測得NO的殘留率與溫度關系如圖2所示。隨著溫度不斷升高,NO的殘留率趨近相同的可能原因是n(NH3)n(NO)。組卷:12引用:1難度:0.5 -
23.研究高效催化劑是解決汽車尾氣中的NO和CO對大氣污染的重要途徑。
(1)已知:C(s)+O2(g)═CO2(g)△H1=-393.5 kJ/mol
C(s)+O2(g)═CO(g)△H2=-110.5 kJ/mol12
N2(g)+O2(g)═2NO(g)△H3=+180.0 kJ/mol
則汽車尾氣的催化轉化反應2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=kJ/mol。
(2)400℃時,在分別裝有催化劑A和B的兩個容積為2 L的剛性密閉容器中,各充入物質的量均為n mol的NO和CO發生上述反應。通過測定容器內總壓強隨時間變化來探究催化劑對反應速率的影響,數據如下表;
①由上表可以判斷催化劑時間/min 0 10 20 30 ∞ A容器內壓強/kPa 75.0 70.0 65.0 60.0 60.0 B容器內壓強/kPa 75.0 71.0 68.0 66.0 60.0 (填“A”或“B”)的效果更好。
②容器中CO的平衡轉化率為。400℃時,用壓強表示的平衡常數Kp=(kPa)-1(保留兩位小數)。
③汽車尾氣排氣管中使用催化劑可以提高污染物轉化率,其原因是。
(3)為研究氣缸中NO的生成,在體積可變的恒壓密閉容器中,高溫下充入物質的量均為1 mol的氮氣和氧氣,發生反應N2(g)+O2(g)?2NO(g)。
①下列說法能表明該反應已經達到平衡狀態的是(填序號)。
A.2v正(O2)=v逆(NO)
B.混合氣體的平均相對分子質量不變
C.c(N2):c(O2)=1
D.容器內溫度不變
②為減小平衡混合氣中NO的體積分數,可采取的措施是。
(4)對于氣缸中NO的生成,化學家提出了如下反應歷程:
第一步 O2?2O 慢反應
第二步 O+N2?NO+N 較快平衡
第三步 N+O2?NO+O 快速平衡
下列說法錯誤的是(填標號)。
A.第一步反應不從N2分解開始,是因為N2比O2穩定
B.N、O原子均為該反應的催化劑
C.三步反應中第一步反應活化能最大
D.三步反應的速率都隨溫度升高而增大組卷:40引用:4難度:0.4


