2019-2020學年甘肅省慶陽市寧縣二中萃英班高二(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題3分,共48分。每小題均只有一個選項符合題意)
-
1.人類將在未來逐漸由“碳素燃料文明時代”過渡至“太陽能文明時代”(包括風能、生物質能等太陽能轉換形態),屆時人們將適應“低碳經濟”和“低碳生活”。下列說法錯誤的是( )
A.煤、石油和天然氣都屬于碳素燃料 B.發展太陽能經濟有助于減緩溫室效應 C.太陽能電池可將太陽能直接轉化為電能 D.目前研究菠菜蛋白質“發電”不屬于“太陽能文明” 組卷:170引用:12難度:0.8 -
2.下列圖示關系中不正確的是( )
A. 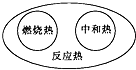
B. 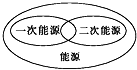
C. 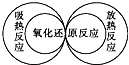
D. 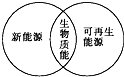 組卷:44引用:11難度:0.9
組卷:44引用:11難度:0.9 -
3.只改變一個影響因素,平衡常數K與化學平衡移動的關系敘述錯誤的是( )
A.K值不變,平衡可能移動 B.K值變化,平衡一定移動 C.平衡移動,K值可能不變 D.平衡移動,K值一定變化 組卷:500引用:73難度:0.6 -
4.下列措施或事實不能用勒沙特列原理解釋的是( )
A.工業上生產硫酸的過程中,使用過量的空氣以提高SO2的利用率 B.H2、I2、HI平衡混合氣加壓后顏色變深 C.實驗室中常用排飽和食鹽水的方法收集氯氣 D.開啟啤酒瓶后,瓶中馬上泛起大量泡沫 組卷:11引用:3難度:0.9 -
5.在一密閉容器中發生反應:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),下列判斷正確的是( )
A.升高反應溫度對反應限度無影響 B.改變H2的濃度對正反應速率無影響 C.保持體積不變,充入N2反應速率增大 D.保持壓強不變,充入N2反應速率減小 組卷:67引用:2難度:0.8 -
6.根據反應Br+H2?HBr+H的能量對反應歷程的示意圖甲進行判斷,下列敘述中不正確的是( )
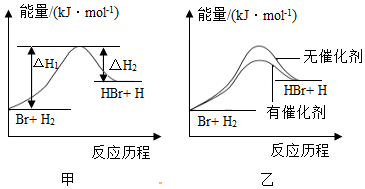
A.正反應吸熱 B.加入催化劑,該化學反應的反應熱不變 C.加入催化劑后,該反應的能量對反應歷程的示意圖可用圖乙表示 D.加入催化劑可增大正反應速率,降低逆反應速率 組卷:181引用:25難度:0.9 -
7.下列由生產或實驗事實得出的相應結論不正確的是( )
選項 生產或實驗事實 結論 A 其他條件相同,Na2S2O3溶液和H2SO4溶液反應,升高溶液的溫度,析出硫沉淀所需時間縮短 其它條件不變時,升高溫度,化學反應速率增大 B 工業制硫時,在SO3的吸收階段,吸收塔里裝填瓷環,增大氣液接觸面積 SO3的吸收速率增大 C 在容積可變的密閉容器中發生反應:2NH3(g)→N2H3(l)+H2(g),把容器的容縮小一半 正反應速率增大,逆反應速率減小 D 在A、B兩支試管這分別加入等體積5%的H2O2溶液,在B試管中加入2~3滴FeCl3溶液,B試管中產生氣泡快 當其他條件不變時,催化劑可以加快化學反應速率 A.A B.B C.C D.D 組卷:10引用:2難度:0.6
二、非選擇題(共52分)
-
21.2015年冬季,我國城市空氣污染狀況受到人們的強烈關注,其中NOx、CO、SO是主要污染性氣體。汽車內燃機工作時,氮氣和氧氣反應生成NO氣體是導致汽車尾氣中含有NO的重要原因之一,已知:每生成30gNO氣體吸收90.4kJ熱量。
(1)試寫出內燃機工作時生成NO的熱化學方程式:;
(2)利用催化技術可將汽車尾氣中的NO氣體轉化成無毒氣體,相關反應的平衡常數可表示為K=,此反應為放熱反應。在一定溫度下,5L某密閉容器中發生上述反應,各物質的物質的量的變化情況如表:c(N2)c2(CO2)c2(CO)c2(NO)
①根據上表數據計算0~4s間用NO表示的平均速率v(NO)=時間/s 0 1 2 3 4 5 6 n(NO)/mol 1.000 0.450 0.250 0.150 0.100 0.100 0.092 n(CO)/mol 3.600 3.050 3.050 2.750 2.700 2.700 2.692 n(N2)/mol 0 0.275 0.275 0.425 0.450 0.450 0.454 n(CO2)/mol 0 0.550 0.550 0.850 0.900 0.900 ;達到化學平衡時兩種反應物的轉化率是否相等(填“相等”或“不相等”)。
②在5~6s時,若K增大,5s后正反應速率(填“增大”或“減小”)
③在5~6s時,若K不變,以上各物質的物質的量變化原因可能是;
A.選用更有效的催化劑
B.縮小容器的體積
C.降低CO2濃度
D.升高溫度組卷:1引用:1難度:0.5 -
22.甲醇被稱為21世紀的新型燃料,工業上通過下列反應I和Ⅱ,用CH4和H2O為原料來制備甲醇.
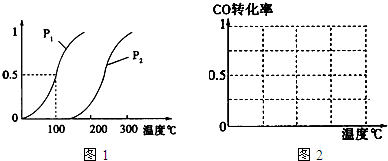
(1)將1.0mol CH4和2.0mol H2O(g)通入反應室(容積為100L),在一定條件下發生反應:CH4(g)+H2O(g)?CO(g)+3H2(g)Ⅰ
CH4的平衡轉化率與溫度、壓強的關系如圖1.①已知100℃時達到平衡所需的時間為5min,則用H2表示的平均速率為.
②圖中的P1P2(填“<”、“>”或“=”),100℃時平衡常數的值為.
③在其它條件不變的情況下降低溫度,逆反應速率將(填“增大”“減小”或“不變”).
(2)在壓強為0.1MPa條件下,將a mol CO與3a mol H2的混合氣體在催化劑作用下能自發反應生成甲醇:CO(g)+2H2(g)?CH3OH(g)Ⅱ.
④該反應的△H0,△S0(填“<”、“>”或“=”).
⑤若容器容積不變,下列措施可增加甲醇產率的是.
A.升高溫度 B.將CH3OH(g)從體系中分離
C.充入He,使體系總壓強增大 D.再充入1mol CO和3mol H2
⑥為了尋找合成甲醇的溫度和壓強的適宜條件,某同學設計了三組實驗,部分實驗條件已經填在下面實驗設計表中.
A.請在上表空格中填入剩余的實驗條件數據.實驗編號 T(℃) n(CO)/n(H2) P(MPa) i 150 130.1 ii 5 iii 350 5
B.根據反應Ⅱ的特點,在給出的坐標圖中,畫出其在0.1MPa和5MPa條件下CO的轉化率隨溫度變化的趨勢曲線示意圖(如圖2),并標明各曲線的壓強.組卷:18引用:4難度:0.3


