2016-2017學年遼寧省盤錦高中高三(上)周測化學試卷(10.7)
發布:2024/4/20 14:35:0
一、選擇題(共11小題,每小題3分,滿分33分)
-
1.下列物質在水溶液中的電離方程式書寫正確的是( )
A.CH3COOH?H++CH3COO- B.NaHSO4═Na++ HSO-4C.H3PO4?3H++ PO3-4D.NaHCO3?Na++H++ CO2-3組卷:1057引用:13難度:0.5 -
2.下列各組關于強電解質.弱電解質.非電解質的歸類正確的( )
A B C D 強電解質 Fe NaCl CaCO3 HNO3 弱電解質 CH3COOH NH3 H2CO3 Fe(OH)3 非電解質 蔗糖 BaSO4 C2H5OH H2O A.A B.B C.C D.D 組卷:1053引用:86難度:0.7 -
3.把0.05mol NaOH固體分別加入到下列100mL溶液中,導電能力變化較大的是( )
A.0.5mol/LMgSO4溶液 B.0.5mol/L鹽酸 C.0.5mol/L的CH3COOH溶液 D.0.5mol/LNH4Cl溶液 組卷:237引用:6難度:0.7 -
4.甲酸是一種一元有機酸.下列性質可以證明它是弱電解質的是( )
A.甲酸能與水以任意比互溶 B.1mol?L-1甲酸溶液的pH約為2 C.10mL 1mol?L-1甲酸恰好與10mL 1mol?L-1NaOH溶液完全反應 D.甲酸溶液的導電性比鹽酸的弱 組卷:479引用:8難度:0.9 -
5.已知下面三個數據:7.2×10-4、4.6×10-4、4.9×10-10分別是下列有關的三種酸的電離常數,若已知下列反應可以發生:NaCN+HNO2→HCN+NaNO2 NaCN+HF→HCN+NaF NaNO2+HF→HNO2+NaF,由此可判斷下列敘述不正確的是( )
A.K(HF)=7.2×10-4 B.K(HNO2)=4.9×10-10 C.必須根據其中三個反應才可得出結論 D.K(HCN)<K(HNO2)<K(HF) 組卷:25引用:6難度:0.5 -
6.在已達到電離平衡的0.1mol/L的醋酸溶液中,欲使平衡向電離的方向移動,同時使溶液的pH降低,應采取的措施是( )
A.加少量鹽酸 B.加熱 C.加少量醋酸鈉晶體 D.加少量NaOH晶體 組卷:14引用:8難度:0.9
二、非選擇題:
-
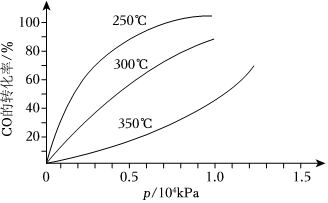 17.CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)?CH3OH(g).CO在不同溫度下的平衡轉化率與壓強的關系如圖所示.該反應△H 0(填“>”或“<”).實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是.組卷:17引用:4難度:0.5
17.CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)?CH3OH(g).CO在不同溫度下的平衡轉化率與壓強的關系如圖所示.該反應△H 0(填“>”或“<”).實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是.組卷:17引用:4難度:0.5 -
18.(1)反應I2+2S2O32-=2I-+S4O62-常用于精鹽中碘含量測定。某同學利用該反應探究濃度對反應速率的影響。實驗時均加入1mL淀粉溶液做指示劑,若不經計算,直接通過褪色時間的長短判斷濃度與反應速率的關系,下列試劑中應選擇
(填序號)。
①1mL 0.01mol?L-1的碘水 ②1mL 0.001mol?L-1的碘水
③4mL 0.01mol?L-1的Na2S2O3溶液 ④4mL 0.001mol?L-1的Na2S2O3溶液
(2)若某同學選取①③進行實驗,測得褪色時間為4s,計算υ(S2O32-)=。組卷:22引用:3難度:0.3


