2019-2020學年北京市高二(上)期中化學試卷(選修)
發布:2024/4/20 14:35:0
一、選擇題(48分,每小題3分,共16小題)
-
1.化學反應速率的研究對于工農業生產和日常生活有著十分重要的意義,下列說法正確的是( )
A.將肉類食品進行低溫冷藏,能使其永遠不會腐敗變質 B.在化學工業中,選用合適的催化劑一定能提高經濟效益 C.夏天面粉的發酵速度與冬天面粉的發酵速度相差不大 D.茶葉的包裝袋中加入的還原性鐵粉,能顯著延長茶葉的儲存時間 組卷:107引用:9難度:0.8 -
2.下列有關能量轉換的說法正確的是 ( )
A.煤燃燒是熱能轉化為化學能的過程 B.動物體內葡萄糖被氧化成CO2是熱能轉變成化學能的過程 C.植物通過光合作用將CO2轉化為葡萄糖是太陽能轉變成熱能的過程 D.化石燃料屬于一次能源,電能屬于二次能源 組卷:46引用:5難度:0.7 -
3.下列關于反應熱的敘述正確的是( )
A.當△H<0時,表示該反應為吸熱反應 B.由C(s)+ O2(g)═CO(g)的反應熱為110.5 kJ?mol-1,可知碳的燃燒熱為110.5 kJ?mol-112C.反應熱的大小與反應物所具有的能量和生成物所具有的能量無關 D.1 mol NaOH分別和1 mol CH3COOH、1 mol HNO3反應放出的熱量:CH3COOH<HNO3 組卷:17引用:6難度:0.6 -
4.化學用語不正確的是( )
A.醋酸的電離:CH3COOH?CH3COO-+H+ B.碳酸氫鈉在水溶液中的電離:NaHCO3?Na++ HCO-3C.氯化銨的水解: +H2O?NH4OH+H+NH+4D.碳酸鈣的溶解平衡:CaCO3(s)?Ca2+(aq)+ (aq)CO2-3組卷:125引用:11難度:0.9 -
5.下列說法正確的是( )
A.升高溫度能使化學反應速率增大,主要原因是增大了反應物分子中的活化分子百分數 B.等質量的鋅粉和鋅片分別與等體積等濃度的鹽酸反應,反應速率相等 C.用鐵片與硫酸反應制備氫氣時,用濃硫酸可以加快產生氫氣的速率 D.催化劑不影響反應的活化能但能增大單位體積內的活化分子百分數,從而增大反應速率 組卷:3引用:1難度:0.6 -
6.下列四種溶液中,水的電離程度最大的是( )
A.pH=5的NH4Cl溶液 B.pH=5的NaHSO4溶液 C.pH=8的CH3COONa溶液 D.pH=8的NaOH溶液 組卷:475引用:16難度:0.9
二、非選擇題(共52分)
-
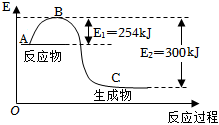 19.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用.
19.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用.
(1)如圖是N2(g)和H2(g)反應生成1mol NH3(g)過程中能量的變化示意圖,請寫出N2和H2反應的熱化學方程式:.
(2)若已知下列數據:
試根據表中及圖中數據計算N-H的鍵能:化學鍵 H-H N≡N 鍵能/kJ?mol-1 435 943 kJ?mol-1.
(3)用NH3催化還原NOx還可以消除氮氧化物的污染.已知:
4NH3(g)+3O2(g)═2N2+6H2O(g)△H1=-a kJ?mol-1①
N2(g)+O2(g)═2NO(g)△H2=-b kJ?mol-1②
求:若1mol NH3還原NO至N2,則該反應過程中的反應熱△H3=kJ?mol-1(用含a、b的式子表示).
(4)捕碳技術(主要指捕獲CO2)在降低溫室氣體排放中具有重要的作用.目前NH3和(NH4)2CO3已經被用作工業捕碳劑,它們與CO2可發生如下可逆反應:
反應Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反應Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反應Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
請回答下列問題:
△H3與△H1、△H2之間的關系是△H3=.組卷:21引用:5難度:0.5 -
20.砷(As)是一些工廠和礦山廢水中的污染元素,使用吸附劑是去除水中砷的有效措施之一.
(1)將硫酸錳、硝酸釔與氫氧化鈉溶液按一定比例混合,攪拌使其充分反應,可獲得一種砷的高效吸附劑X,吸附劑X中含有,其原因是CO2-3.
(2)H3AsO3和H3AsO4水溶液中含砷的各物種的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系分別如圖-1和圖-2所示.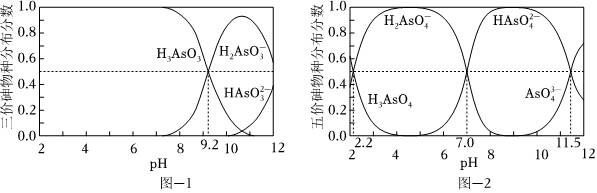
①以酚酞為指示劑(變色范圍pH 8.0~10.0),將NaOH溶液逐滴加入到H3AsO3溶液中,當溶液由無色變為淺紅色時停止滴加.該過程中主要反應的離子方程式為.
②H3AsO4第一步電離方程式H3AsO4?H2+H+的電離常數為Ka1,則pKa1=AsO-4(p Ka1=-lg Ka1 ).
(3)溶液的pH對吸附劑X表面所帶電荷有影響.pH=7.1時,吸附劑X表面不帶電荷;pH>7.1時帶負電荷,pH越高,表面所帶負電荷越多;pH<7.1時帶正電荷,pH越低,表面所帶正電荷越多.pH不同時吸附劑X對三價砷和五價砷的平衡吸附量(吸附達平衡時單位質量吸附劑X吸附砷的質量)如圖-3所示.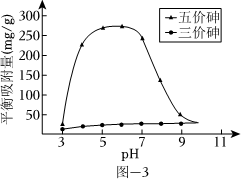
①在pH 7~9之間,吸附劑X對五價砷的平衡吸附量隨pH升高而迅速下降,其原因是.
②在pH 4~7之間,吸附劑X對水中三價砷的去除能力遠比五價砷的弱,這是因為.提高吸附劑X對三價砷去除效果可采取的措施是.組卷:1318引用:11難度:0.3


