2022-2023學年江西省南昌二中高三(上)第四次月考化學試卷
發布:2024/9/22 6:0:8
一、單選題(每小題3分,共48分,每道題只有一個正確選項。)
-
1.中國古代文化中蘊含了豐富的化學知識,下列說法不正確的是( )
A.“日照香爐生紫煙”的“煙”是瀑布的細小水珠形成的水霧,云、霧屬于氣溶膠 B.唐?李商隱:“滄海月明珠有淚,藍田日暖玉生煙”。文中涉及的珍珠、玉石的主要成分都是硅酸鹽 C.《客中行》:“蘭陵美酒郁金香,玉碗盛來琥珀光。但使主人能醉客,不知何處是他鄉。”糧食發酵產生的酒精分散在酒糟中,可以通過蒸餾與酒糟分離 D.宋?王希孟《千里江山圖》所用紙張為宣紙,其主要成分為一種有機高分子 組卷:22引用:2難度:0.8 -
2.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.25g46%的乙醇水溶液中含有的氫原子數為3NA B.將22.4L(標準狀況)Cl2通入足量水中,轉移的電子數為NA C.12gNaHSO4固體中含陽離子數目為0.2NA D.64gSO2和32gO2混合,反應一段時間后總原子數為4NA 組卷:85引用:3難度:0.5 -
3.化學鍵是高中化學中非常重要的一個概念,它與物質變化過程中的能量變化息息相關,下列說法正確的是( )
①化學鍵是存在相鄰原子(或離子)間強烈的相互作用
②活潑金屬元素與活潑非金屬元素一定形成離子鍵
③碳酸鈉固體中既存在離子鍵又存在共價鍵
④速滑館“冰絲帶”用干冰作為制冷劑,干冰升華過程中破壞了共價鍵
⑤物理變化也可以有化學鍵的破壞
⑥化學變化中一定有化學鍵的斷裂和形成,所以一定伴隨能量的變化
⑦吸熱反應一定需要加熱
⑧氫鍵是化學鍵中的一種,會影響物質的熔沸點A.①③⑤⑥ B.③④⑤⑧ C.①②③⑤ D.③⑤⑥⑦ 組卷:4引用:3難度:0.7 -
4.下列實驗中不能達到實驗目的的是( )
A. 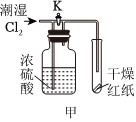
裝置甲可用于驗證潮濕氯氣與干燥氯氣的漂白性B. 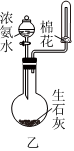
利用圖乙制取并收集少量的NH3C. 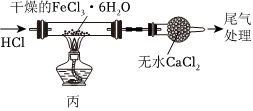
用丙裝置制備無水FeCl3D. 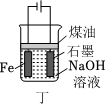
用丁裝置制備Fe(OH)2并能較長時間觀察其顏色組卷:1引用:3難度:0.5 -
5.下列離子方程式正確的是( )
A.向含Fe3+的CuSO4溶液中加入適量CuO:2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+ B.向AgNO3溶液中加入過量氨水:Ag++NH3?H2O=AgOH↓+ NH+4C.Cu2O加入足量稀硝酸中:Cu2O+2H+=Cu+Cu2++H2O D.向漂白粉溶液中通入過量的SO2:ClO-+SO2+H2O= +HClOHSO-3組卷:5引用:2難度:0.7 -
6.下列說法中正確的是( )
A.若 2NO2(g)?N2O4(g)△H=-56.9kJ?mol-1,則2molNO2(g)置于密閉容器中充分反應放出的熱量為56.9kJ B.已知甲烷、一氧化碳、氫氣的燃燒熱分別是890.3kJ/mol、283kJ/mol、285.8kJ/mol。則:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3kJ/mol C.在稀溶液中,強酸與強堿反應的中和熱為ΔH=-57.3kJ?mol-1,若將含有0.5molH2SO4的濃硫酸和含有1molNaOH的溶液混合,放出的熱量等于57.3kJ D.H2(g)的燃燒熱是285.8kJ?mol-1,則2H2O(g)=2H2(g)+O2(g)△H=+571.6kJ?mol-1 組卷:6引用:2難度:0.7
二、非選擇題(共52分)
-
19.乙烯是一種重要的基本化工原料,乙烯的產量可以衡量一個國家的石油化工發展水平,研究工業制取乙烯有重要的意義。
Ⅰ.工業用H2和CO2在一定條件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g) ΔH1
已知:①2H2(g)+O2(g)=2H2O(l)ΔH2=-571.4kJ?mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(l)ΔH3=-1411kJ?mol-1
③H2O(g)=H2O(l)ΔH4=-44kJ?mol-1
(1)ΔH1=。
(2)在恒容密閉容器中充入體積比為3:1的H2和CO2,不同溫度對CO2的平衡轉化率和催化劑催化效率的影響如圖所示,下列說法正確的是(不定項選擇)。
A.為了提高乙烯的產率應盡可能選擇低溫
B.生成乙烯的速率:v(M)可能小于v(N)
C.平衡常數:KM<KN
D.M點時的壓強一定小于N點時的壓強
Ⅱ.工業用甲烷催化法制取乙烯:2CH4(g)?C2H4(g)+2H2(g) ΔH>0,T℃時,向4L的恒容反應器中充入2molCH4,僅發生上述反應,反應過程中CH4的物質的量隨時間變化如圖所示:
(3)實驗測得v正=k正c2(CH4),v逆=k逆c(C2H4)?c2(H2),k正、k逆為速率常數,只與溫度有關,T℃時k正與k逆的比值為(用含x的代數式表示);若將溫度升高,速率常數增大的倍數:k正(填“>”“=”或“<”)k逆。
Ⅲ.乙烷裂解制乙烯:C2H6(g)?C2H4(g)+H2(g)。
(4)T℃時,將乙烷與氦氣體積比2:1混合后,通入一恒壓容器中發生反應。平衡時容器壓強為PPa,若乙烷的平衡轉化率為50%,反應的平衡常數Kp=(用分壓表示,分壓=總壓×物質的量分數)。組卷:9引用:2難度:0.5 -
20.精制黑鎢礦的主要成分為FeWO4、MnWO4,同時還含有少量Si的化合物。工業上由黑鎢礦冶煉金屬鎢并獲取副產物的流程如圖:

已知:①燒結物的主要成分為Fe2O3、MnO2、Na2SiO3、Na2WO4;
②上述流程中,鎢的化合價只在生成鎢單質的反應中發生改變;
③常溫下,鎢酸是難溶于水的弱酸。
請回答下列問題:
(1)為了提高黑鎢礦焙燒速率,可以采取的措施有(寫出一種即可),寫出在焙燒條件下與純堿、空氣反應生成Fe2O3的化學方程式。
(2)從本題流程可以得出,同濃度的硅酸根離子比鎢酸根離子結合質子能力(填“強”或“弱”)。
(3)“操作1”用到的玻璃儀器除燒杯外還有,若濾渣1用稀硫酸浸泡,則固體A主要成分的化學式為。
(4)寫出MnO2與硫酸、草酸(H2C2O4)溶液反應的離子方程式為。
(5)工業“沉錳”過程中常選用NH4HCO3溶液作沉淀劑,若用碳酸鹽代替NH4HCO3溶液可能產生其它固體雜質,該雜質可能為(填化學名稱)。組卷:4引用:2難度:0.5


