2022年天津市南開區高考化學一模試卷
發布:2024/12/26 8:0:14
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.化學與生產、生活密切相關。下列說法正確的是( )
A.華為自主研發的麒麟芯片主要成分為SiC B.三星堆出土的青銅面具與銅相比,具有熔點高、硬度大的特點 C.核酸檢測是確認病毒類型的有效手段,核苷酸縮合聚合可以得到核酸 D.碳纖維材料操縱棒是宇航員的手臂“延長器”,碳纖維屬于有機高分子材料 組卷:53引用:1難度:0.6 -
2.下列有關化學用語表示正確的是( )
A.丙烯的實驗式:C3H6 B.甲醛的分子結構模型 
C. 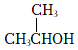 的名稱:1-甲基乙醇
的名稱:1-甲基乙醇D.基態氮原子的價電子排布式:2p3 組卷:56引用:2難度:0.7 -
3.下列物質的化學成分不正確的是( )
A.重晶石:BaSO4 B.油酸:C17H35COOH C.芒硝:Na2SO4?10H2O D.甘氨酸:H2NCH2COOH 組卷:30引用:1難度:0.7 -
4.下列指定反應的離子方程式正確的是( )
A.向FeBr2溶液中通入過量 Cl2:2Fe2++Cl2═2Fe3++2Cl- B.將銅絲插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O C.惰性電極電解MgCl2溶液:2Cl?+2H2O 2OH?+H2↑+Cl2↑電解D.向Al2(SO4)3溶液中加入過量氨水:Al3++3NH3?H2O═Al(OH) 3↓+3NH4+ 組卷:83引用:2難度:0.7 -
5.下列物質可用于處理泄漏的有毒物質 Na2S 的是( )
①臭氧(O3)
②鐵粉
③NaCl
④KI
⑤雙氧水A.①⑤ B.②④ C.③④ D.③⑤ 組卷:50引用:2難度:0.7
二、解答題(共4小題,滿分64分)
-
15.工業上常利用含硫廢水生產Na2S2O3?5H2O,實驗室可用如圖裝置(略去部分夾持儀器)模擬生產過程。
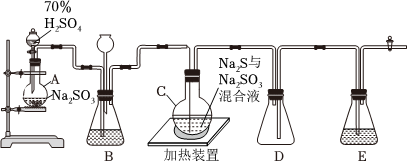
燒瓶C中發生反應如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq)═Na2S2O3(aq)(Ⅲ)
回答下列問題:
(1)儀器組裝完成后,關閉兩端活塞,向裝置B中的長頸漏斗內注入液體至形成一段液柱,若,則整個裝置氣密性良好。裝置E中為溶液。
(2)為提高產品純度,應使燒瓶C中Na2S和Na2SO3恰好完全反應,則燒瓶C中Na2S和Na2SO3物質的量之比為。
(3)裝置B的作用之一是觀察SO2的生成速率,其中的液體最好選擇溶液。
(4)實驗中,為使SO2緩慢進入燒瓶C,采用的操作是。
(5)已知反應(Ⅲ)相對較慢,則燒瓶C中反應達到終點的現象是。
(6)反應終止后,燒瓶C中的溶液經、冷卻結晶即可析出Na2S2O3?5H2O,其中可能含有Na2SO3、Na2SO4等雜質。請設計實驗檢測產品中是否存在Na2SO4,簡要說明實驗操作、現象和結論:。
(7)燒瓶C中的實驗一般控制在堿性環境下進行,否則產品發黃,用離子反應方程式表示其原因:。
(8)準確稱取2.000g產品,用適量蒸餾水溶解,以淀粉作指示劑,用0.1000mol?L-1碘的標準溶液滴定,反應原理為:2S2+I2═S4O2-3+2I-。消耗碘的標準溶液體積為18.00mL,則產品的純度為O2-6(已知Na2S2O3?5H2O的相對分子質量為248)。組卷:157引用:2難度:0.6 -
16.我國提出爭取在2030年前實現“碳達峰”,2060年前實現“碳中和”,這對于改善環境,實現綠色發展至關重要。“碳中和”是指將人類經濟社會活動所必需的碳排放,通過植樹造林和其他人工技術或工程加以捕集利用或封存,從而使排放到大氣中的二氧化碳凈增量為零。下列各項措施能夠有效促進“碳中和”。回答下列問題:
I.將CO2轉化為炭黑進行回收利用,反應原理如圖所示。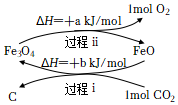
(1)從能量角度分析FeO的作用是。
(2)寫出炭黑和氧氣轉化為CO2的熱化學方程式:。
II.以CO2和甲醇為原料直接合成碳酸二甲酯(CH3OCOOCH3)的反應為CO2(g)+2CH3OH(g)?CH3OCOOCH3(g)+H2O(g)ΔH。
在不同的實驗條件下,測定甲醇的轉化率。溫度的數據結果為圖a,壓強的數據結果在圖b中未畫出。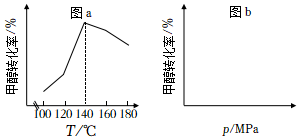
(3)該反應的ΔH0(填“>”或“<”)。
(4)在100~140℃之間,隨著溫度升高,甲醇轉化率增大的原因是。
(5)在圖b中繪制出壓強和甲醇轉化率之間的關系(作出趨勢即可)。
III.利用Al-CO2電池(工作原理如圖所示)能有效地將CO2轉化成化工原料草酸鋁Al2(C2O4)3。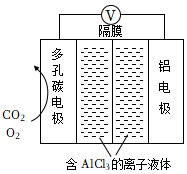
(1)電池的總反應式為。
(2)電池的正極反應式:2CO2+2e-=C2O42-(草酸根)正極反應過程中,O2是催化劑,催化過程可表示為:①6O2+6e-=6O2-②…。寫出反應②的離子方程式:。組卷:91引用:1難度:0.6


