2021-2022學年天津市北師大靜海附屬學校高二(上)第一次調研化學試卷
發布:2024/4/20 14:35:0
一、單選題(共48分)
-
1.下列反應屬于放熱反應的是( )
A.NH4Cl與Ba(OH)2?8H2O反應 B.Na與H2O反應 C.C與CO2高溫反應生成CO D.CaCO3分解制備CaO 組卷:7引用:2難度:0.7 -
2.熱化學方程式2H2O2(l)?2H2O(l)+O2(g) Δ=-196kJ?mol-1,下列說法正確的是( )
A.生成11.2LO2時放熱98kJ B.反應物總能量小于生成物總能量 C.H2O為氣態時,放出的熱量大于196kJ D.正反應的活化能小于逆反應的活化能 組卷:14引用:2難度:0.7 -
3.下列熱方程式書寫正確的是( )
A.2SO2+O2=2SO3△H=-196.6 kJ/mol B.2H2(g)+O2(g)=2H2O(l)△H=-517.6 kJ/mol C.H2(g)+ O2(g)=H2O(l)△H=-285.8 kJ12D.C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol 組卷:39引用:5難度:0.9 -
4.下列措施不是為了改變化學反應速率的是( )
A.加工饅頭時添加膨松劑 B.將食物存放在冰箱中 C.糕點包裝袋內放置除氧劑 D.冶鐵時將鐵礦石粉碎 組卷:46引用:11難度:0.5 -
 5.科學家結合實驗和計算機模擬結果,研究了在貴重金屬催化劑表面上的氣態體系中,一個CO分子還原NO的能量變化與反應歷程如圖所示。下列說法錯誤的是( )
5.科學家結合實驗和計算機模擬結果,研究了在貴重金屬催化劑表面上的氣態體系中,一個CO分子還原NO的能量變化與反應歷程如圖所示。下列說法錯誤的是( )A.使用催化劑,不能改變反應的焓變 B.決定整個反應速率快慢的是反應① C.B物質比反應物和生成物都穩定 D.該反應的熱化學方程式為2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=(Ed-Ea) kJ?mol?1 組卷:38引用:3難度:0.5
二、填空題(共52分)
-
16.某小組利用H2C2O4溶液和硫酸酸化的KMnO4溶液反應來探究“外界條件對化學反應速率的影響”。實驗時通過測定酸性KMnO4溶液褪色所需時間 來判斷反應的快慢。該小組設計了如下方案。已知:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO2+10CO2↑+8H2O
(1)表中V1=
實驗 編號0.1mol/L酸性 KMnO4溶液的體積
/mL0.6mol/LH2C2O4
溶液的體積
/mLH2O的 體積
/mL
實驗溫度
/℃
溶液褪色所 需時間/min① 10 V1 35 25
t1② 10 10 30 25
t2③ 10 10 V2 50
t3mL,V2=mL。
(2)探究溫度對化學反應速率影響的實驗編號是(填編號,下同),可 探究反應物濃度對化學反應速率影響的實驗編號是。
(3)實驗①測得KMnO4溶液的褪色時間為2min,忽略混合前后溶液體積的微小變化,這段時間內平均反應速率v(H2C2O4)=mol?L-1?min-1。組卷:39引用:7難度:0.5
三、實驗題(共13分)
-
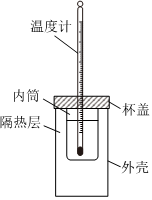 17.反應熱的數值可以通過理論計算得出,也可以通過實驗測得。某實驗探究小組用0.50mol?L-1的NaOH溶液和0.50mol?L-1的硫酸溶液進行中和反應的反應熱的測定。
17.反應熱的數值可以通過理論計算得出,也可以通過實驗測得。某實驗探究小組用0.50mol?L-1的NaOH溶液和0.50mol?L-1的硫酸溶液進行中和反應的反應熱的測定。
(1)若實驗中需要使用250 mL NaOH溶液,則在配制時應稱量NaOH固體g。
(2)從實驗裝置上看,還缺少,裝置中隔熱層的作用是。利用上述NaOH溶液和硫酸溶液反應測定中和反應的反應熱的實驗裝置如圖所示。
(3)取50mLNaOH溶液和30mL硫酸溶液進行實驗,實驗數據如表:
①近似認為0.50mol?L-1的NaOH溶液和0.50mol?L-1的硫酸溶液的密度都是1g?cm-3,反應后所得溶液的比熱容為4.18J/(g℃)。則該中和反應生成1mol水時反應熱ΔH=
實驗次數起始溫度t1/℃
最高溫度t2/℃硫酸溶液 NaOH溶液 平均值 1 26.2 26.0 26.1 30.5 2 25.9 25.9 25.9 30.5 3 26.0 26.2 26.1 32 (計算結果精確到小數點后一位)。若用30mL1mol/L醋酸代替H2SO4溶液進行上述實驗,測得反應后的ΔH(填“偏大”“偏小”或“不受影響”)。
②上述實驗結果與理論值(-57.3kJ?mol-1)有偏差,產生偏差的原因不可能是(填序號)。
A.實驗裝置保溫、隔熱效果差
B.用溫度計測量最高溫度時俯視讀數
C.用溫度計測定過NaOH溶液的起始溫度后,直接測定硫酸溶液的溫度
D.把NaOH溶液分多次倒入盛有硫酸溶液的小燒杯中組卷:11引用:4難度:0.7


