2021-2022學年湖北省武漢市部分重點中學高一(下)期中化學試卷
發布:2024/12/21 16:30:3
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一個選項是符合題目要求的。
-
1.下列說法正確的是( )
A.SO2和SiO2都是酸性氧化物,均不能和任何酸反應 B.硫、氮、硅三種元素在自然界中既存在游離態,又存在化合態 C.利用硅的半導體性能制作芯片,因此高純硅廣泛應用于信息技術 D.Fe2+和NO3-一定不能大量共存 組卷:14引用:1難度:0.7 -
2.“空氣變面包,氨功不可沒”。下列說法正確的是( )
A.NH3易溶于水,故液氨可用作制冷劑 B.氨氣是堿性氣體,故可用CaCl2干燥NH3 C.氨遇到濃鹽酸、濃硫酸都會發生反應,產生白煙 D.合成氨是人工固氮重要途徑 組卷:42引用:1難度:0.7 -
3.用如圖裝置制取干燥的氣體(a、b表示加入的試劑)能實現的是( )
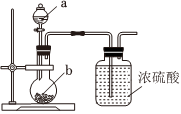
選項 氣體 a b A H2S 稀H2SO4 FeS B SO2 濃H2SO4 Na2SO3 C NO2 濃HNO3 鐵片 D NH3 濃氨水 CaO A.A B.B C.C D.D 組卷:27引用:2難度:0.8 -
4.科學生產中蘊藏著豐富的化學知識。化學改善人類的生活,創造美好的世界。下列生產、生活情境中涉及的原理錯誤的是( )
選項 生產生活情境 原理 A 太陽能電池板被廣泛應用 利用SiO2的光電性質 B 葡萄酒中通常添加少量SO2 既可以殺菌,又可以防止營養成分被氧化 C 世博停車場安裝催化光解設施,可處理汽車尾氣中CO和NOx NOx和CO發生反應生成無毒氣體 D “明如鏡、聲如磬”的瓷器,可由黏土經高溫燒結而成 主要化學成分是硅酸鹽 A.A B.B C.C D.D 組卷:10引用:2難度:0.7 -
5.下列有關實驗操作或結論的敘述中,正確的是( )
A.SO2尾氣處理可用澄清石灰水替代NaOH溶液 B.SO2通入含酚酞的NaOH溶液中紅色褪去,是因為SO2具有漂白性 C.SO2通入紫色石蕊試液,先變紅后褪色 D.向某溶液中先加足量稀鹽酸無明顯現象,再加BaCl2溶液,若產生白色沉淀,則該溶液中一定含有SO42- 組卷:17引用:1難度:0.6 -
6.下列實驗描述正確的是( )
A.濃硫酸能使紙張變黑,這是因為紙張中的纖維素是碳水化合物,濃硫酸吸收了其中的水分 B.S在足量O2中燃燒可生成SO3 C.分別裝有濃H2SO4、濃硝酸的試管,在空氣中久置,質量均增加 D.標準狀況下,用一充滿氨氣的干燥燒瓶做噴泉實驗,當水充滿整個燒瓶后(假設溶液不外溢),燒瓶內氨水的物質的量濃度為 mol/L122.4組卷:26引用:2難度:0.7
二、非選擇題:本題共4小題,共55分。
-
18.合成氨的反應對人類解決糧食問題貢獻巨大,德國化學家F.Haber因合成氨而獲得諾貝爾獎。合成氨反應熱化學方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol。
(1)已知N2(g)+3H2(g)?2NH3(g)不加入催化劑時正反應的活化能為326kJ/mol,則該反應逆反應的活化能為kJ/mol。
(2)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol,H2的燃燒熱△H=-285.8kJ/mol。則NH3(g)+O2(g)=NO(g)+54H2O(1)△H=32kJ/mol
(3)一定溫度下,向恒容的密閉容器中充入一定量的N2和H2發生反應,測得各組分濃度隨時間變化如圖所示。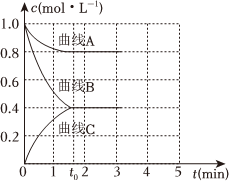
①表示c(H2)變化的曲線是(填“曲線A”“曲線B”或“曲線C”)。
②0~t0時用NH3表示的化學反應速率為v(NH3)=mol?L-1?min-1
③下列能說明該反應達到平衡狀態的是(填標號)。
A.容器中混合氣體的密度不隨時間變化
B.容器中的n(N2)與n(H2)的比值不隨時間變化
C.斷裂3molH-H的同時斷裂6molN-H鍵
D.3v正(H2)=2v逆(NH3)
(4)合成氨反應在某催化劑條件下的相對能量一反應歷程如圖所示(ad為吸附態):
①該過程中含氮的中間產物有種(填數字)。
②活化能最大的那一步基元反應方程式為。
③下列說法正確的是(填標號)。
A.最后一步NH3(ad)變為NH3(g)為吸熱過程.
B.催化劑參與反應,但不改變合成氨反應的△H
C.催化劑和升溫都能降低反應的活化能,加快合成氨的反應速率
D.使用催化劑和壓縮容器體積加壓都能增大活化分子百分數,加快合成氨反應速率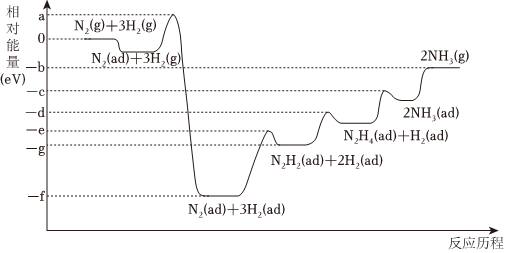 組卷:32引用:1難度:0.6
組卷:32引用:1難度:0.6 -
19.硫酸、硝酸均為重要的化工產品,它們的制備工藝流程示意圖如圖:

回答下列問題。
(1)若上述過程為工業制硫酸。
①若原料A為黃鐵礦(主要成分為FeS2)時,設備I中高溫煅燒后會生成固體廢渣,該廢渣的一種用途是。
②氣體B制備氣體C可在V2O5催化下進行,該反應的機理分為兩步:
第一步:V2O5+SO2=2VO2+SO3 (快)
第二步:(慢)
關于該過程,說法正確的是(填標號)。
A.該過程的反應速率主要取決于第一步
B.VO2是該反應的催化劑
C.增大SO2的濃度可顯著提高反應速率
D.增大O2的濃度可顯著提高反應速率
(2)若上述過程為工業制硝酸,原料A為氨氣。
①氣體C在設備III中轉化為硝酸時,還需要通入氣體E,則氣體E的化學式為,通入氣體E的目的是。
②尾氣中的NO2會形成光化學煙霧和酸雨,污染環境,可用堿性溶液吸收。已知NO2用碳酸鈉溶液吸收時會生成NaNO2,則吸收NO2的離子方程式為。
(3)目前,NaClO溶液廣泛應用于脫硫脫硝。
①某課外小組同學設計了如圖噴淋吸收塔裝置(如圖1),設計該裝置的優點是。
②如圖2為NaClO濃度對脫硫脫硝效率(η/%)的影響。當溫度為50°C,溶液的pH=10(溶液顯堿性),c(SO2)=c(NO)=300mg?m-3時,SO2的脫除效率一直維持在98%以上,而NO脫除效率相對較低,其原因是。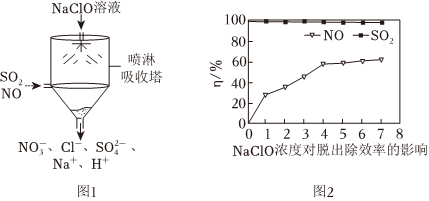 組卷:14引用:1難度:0.6
組卷:14引用:1難度:0.6


