2022-2023學年山東省青島二中高二(上)月考化學試卷(10月份)
發布:2024/12/28 13:30:3
一、單項選擇題(每題3分)
-
1.下列熱化學方程式正確的是( )
選項 已知條件 熱化學方程式 A H2的燃燒熱為akJ?mol-1 H2+Cl2═2HCl ΔH=-akJ?mol-1 B 1molSO2、0.5molO2完全反應后,放出熱量98.3kJ 2SO2(g)+O2(g)?2SO3(g)ΔH=-98.3kJ?mol-1 C H+(aq)+OH-(aq)═H2O(l)
ΔH=-57.3kJ?mol-1H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)ΔH=-114.6kJ?mol-1 D 31g白磷(P4)比31g紅磷(P)能量多bkJ P4(s)=4P(s)ΔH=-4bkJ?mol-1 A.A B.B C.C D.D 組卷:105引用:17難度:0.5 -
2.已知①碳酸鈣的分解CaCO3(s)=CaO(s)+CO2(g)△H 1僅在高溫下自發進行;②氯酸鉀的分解 2KClO3(s)=2KCl(s)+3O2(g)△H 2,在任何溫度下都自發進行,下面有幾組焓變數據,其中可能正確的是( )
A.△H 1=+178.32 KJ?mol -1△H 2=-78.3 kJ?mol -1 B.△H 1=-178.32 kJ?mol -1△H 2=+78.3 kJ?mol -1 C.△H 1=-178.32 kJ?mol -1△H 2=-78.3 kJ?mol -1 D.△H 1=+178.32 kJ?mol -1△H 2=+78.3 kJ?mol -1 組卷:60引用:9難度:0.5 -
3.關于如圖所示各裝置的敘述中,正確的是( )
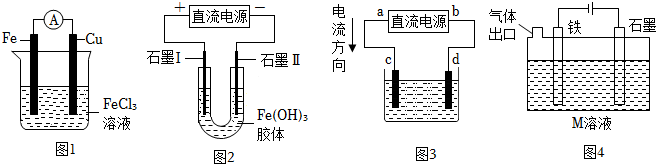
A.圖1是原電池,總反應是:Cu+2Fe3+=Cu2++2Fe2+ B.圖2通電一段時間后石墨Ⅰ電極附近溶液紅褐色加深(已知氫氧化鐵膠粒帶正電荷) C.若用圖3精煉銅,則d極為純銅,電子遷移方向為b→d→c→a D.若用圖4電鍍,M為CuSO4溶液,可以實現在鐵上鍍銅 組卷:44引用:3難度:0.5 -
4.某同學通過實驗研究銅鹽溶液顏色的變化。下列說法不正確的是( )
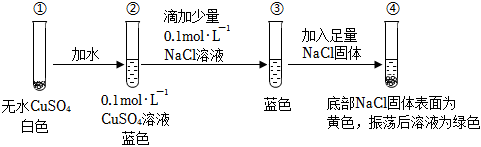
A.由①②可知,②中溶液呈藍色是Cu2+與水分子作用的結果 B.由④可知,Cu2+與Cl-可能會結合產生黃色物質 C.由③④可知,Cl-的濃度對銅鹽溶液的顏色有影響 D.由②③④可知,CuCl2溶液一定為綠色 組卷:107引用:10難度:0.6 -
5.某可逆反應aA(g)+bB(g)?cC(g)ΔH,在某溫度下的平衡常數為K(K≠1),反應熱為ΔH。保持溫度不變,將方程式的書寫作如下改變,則ΔH和K數值的相應變化為( )
A.寫成2aA(g)+2bB(g)?2cC(g),ΔH、K均擴大了一倍 B.寫成2aA(g)+2bB(g)?2cC(g),ΔH擴大了一倍,K保持不變 C.寫成cC(g)?aA(g)+bB(g),ΔH、K變為原來的相反數 D.寫成cC(g)?aA(g)+bB(g),ΔH變為原來的相反數,K變為原來的倒數 組卷:41引用:1難度:0.7
三、填空題
-
15.造成大氣污染的NOx、SO2主要來自于汽車尾氣及工廠廢氣的排放,對其進行處理是我們研究的重要課題。
(1)某汽車安裝的尾氣凈化裝置工作原理如圖所示。下列敘述錯誤的是(填字母)。
A.Pd-Pore催化劑可提高尾氣凈化反應的平衡轉化率
B.NOx的生成主要是與汽油燃燒不充分有關
C.在此變化過程中,NOx被還原
D.在催化劑的作用下,CO、NOx、C3H8都轉化為無毒的物質
(2)已知:2C(s)+O2(g)?2CO(g) ΔH1=-221.0kJ?mol-1
N2(g)+O2(g)?2NO(g) ΔH2=+180.5kJ?mol-1
2NO(g)+2CO(g)?2CO2(g)+N2(g) ΔH3=-746.0kJ?mol-1
則用焦炭還原NO生成無污染氣體的熱化學方程式為。
(3)我國科學家在天然氣脫硫研究方面取得了新進展,利用如圖裝置可發生反應:H2S+O2═H2O2+S↓。
①裝置中H+向池遷移。
②寫出乙池溶液中發生反應的離子方程式。
(4)鈰元素(Ce)常見有+3、+4兩種價態。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和NO2-的吸收液,反應的離子方程式為;現采用電解法將上述吸收液中的NO2-轉化為無毒物質,同時再生Ce4+,其原理如圖所示。
①Ce4+從電解槽的(填字母代號)口流出。
②寫出陰極的電極反應式:。組卷:13引用:2難度:0.6 -
16.工業上,一氧化碳是一碳化學的基礎,可由焦炭氧氣法等方法制得,主要用于生產二甲醚、甲醇和光氣等。回答下列問題:
(1)在工業上可用CO和H2合成二甲醚(CH3OCH3),反應的化學方程式為2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)ΔH=-254.2kJ?mol-1。下列能說明該反應已達平衡狀態的是(填字母)。
A.單位時間內生成1molCH3OCH3(g)的同時消耗了2molCO(g)
B.在恒溫恒容的容器中,混合氣體的密度保持不變
C.在絕熱恒容的容器中,容器內的溫度不再變化
D.在恒溫恒容的容器中,氣體的平均摩爾質量不再變化
(2)已知:Ⅰ.C(s)+H2O(g)?CO(g)+H2(g)ΔH1;
Ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)ΔH2;
①反應C(s)+2H2O(g)?CO2(g)+2H2(g)的ΔH=(用含ΔH1、ΔH2的代數式表示)。
②已知ΔH1>0,對于反應Ⅰ,圖象正確的是(填字母)。
A. B.
B. C.
C. D.
D.
③為了探究反應條件對反應Ⅱ的影響,某活動小組設計了三個實驗,實驗曲線如圖所示。編號 溫度 壓強 c始(CO) c始(H2O) Ⅰ 530℃ 3MPa 1.0mol?L-1 3.0mol?L-1 Ⅱ X 5MPa Y 3.0mol?L-1 Ⅲ 630℃ 5MPa 1.0mol?L-1 3.0mol?L-1 
請依據實驗曲線圖補充完整表格中的實驗條件:X=,Y=;對比實驗Ⅱ和實驗Ⅲ可知,升高溫度,CO的轉化率(填“增大”“減小”或“不變”),ΔH2(填“>”或“<”)0,理由是。編號Ⅰ實驗中,反應達平衡時,CO(g)的轉化率為50%,則530℃時該反應的平衡常數Kp=(以分壓表示,分壓=總壓×物質的量分數)。組卷:13引用:3難度:0.5


