2011年第二十一屆“天原杯”全國初中學生化學素質和實驗能力競賽(河南賽區)初賽試卷
發布:2024/4/20 14:35:0
一、選擇題
-
1.2010年上海世博會“零碳館”中的“碳”主要指( )
A.CO B.CO2 C.CH4 D.C 組卷:5引用:3難度:0.9 -
2.分類法是化學學習和研究的重要方法之一.下列分類正確的是( )
A.常見的干燥劑:濃硫酸、生石灰、堿石灰 B.常見的合金:不銹鋼、石墨、生鐵 C.常見的營養物質:蛋白質、水、合成纖維 D.常見的堿:燒堿、純堿、熟石灰 組卷:11引用:1難度:0.9 -
3.如圖為某元素的原子結構示意圖,下列對該元素的認識正確的是( )
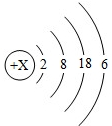
A.該元素屬于金屬元素 B.該元素的原子在化學反應中容易失去電子 C.該元素原子的核外電子總數為18 D.該元素位于元素周期表的第四周期第ⅥA族 組卷:6引用:2難度:0.9 -
4.化學實驗中常涉及實驗操作的先后順序.下列實驗操作不正確的是( )
A.制取氧氣時,先檢查裝置的氣密性,后裝藥品 B.實驗氫氣的可燃性時,先檢驗氫氣的純度,后點燃 C.稀釋濃硫酸時,先向燒杯內加入濃硫酸,后將水沿器壁慢慢注入 D.給試管中的物質加熱時,先均勻預熱,后集中在有藥品的部位加熱 組卷:35引用:5難度:0.9 -
5.二甲醚(C2H6O)以其無污染、易于制造的特征,可能成為一種全新的替代能源而普及.下列有關二甲醚的說法正確的是( )
A.二甲醚由9個原子構成 B.二甲醚的相對分子質量為38 C.二甲醚屬于氧化物 D.二甲醚和甲烷完全燃燒的產物相同 組卷:24引用:3難度:0.9 -
6.李明同學對所學知識進行歸納,其中錯誤的一組是( )
A.性質與用途:氫氣能燃燒且無污染,是清潔能源;銅具有導電性,可制作電線 B.元素與人體健康的關系:人體缺鐵易患貧血癥;人體缺碘易患甲狀腺腫大 C.生活常識:電線著火,立即用水澆滅;飲水解渴,水越純越好 D.環境保護:為減少水污染,要合理使用農藥、化肥;為減少白色污染,用使用可降解塑料 組卷:5引用:2難度:0.9 -
7.以下是幾種氣體的密度(0℃、101kPa)和溶解度(20℃、101kPa).
下列實驗室收集氣體所選用的方法中不正確的是( )H2 CO2 SO2 空氣 密度(g/L) 0.0899 1.977 2.716 1.293 溶解度(g) 0.0001603 0.1688 11.28 A.CO2可用向上排空氣法 B.H2可用向下排空氣法 C.H2可用排水集氣法 D.SO2既可用向上排空氣法,有可用排水法收集 組卷:9引用:1難度:0.9 -
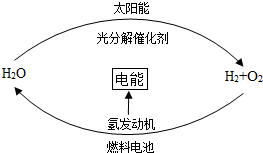 8.目前,科學家提出了一種最經濟最理想的獲得氫能源的循環體系(如圖).下列說法錯誤的是( )
8.目前,科學家提出了一種最經濟最理想的獲得氫能源的循環體系(如圖).下列說法錯誤的是( )A.燃料電池能夠使化學反應產生的能量轉化為電能 B.該氫能源的循環體系能夠實現太陽能轉化為電能 C.在此循環中發生了反應:2H2O 2H2↑+O2↑通電D.目前化學家急需解決的問題是尋找合適的光照條件下分解水的催化劑 組卷:125引用:43難度:0.9 -
9.通過一年的化學學習,你認為下列認識符合科學事實的是( )
A.管道煤氣有刺鼻的氣味,說明一氧化碳有這種特殊氣味;鉛筆芯中含鉛 B.“銀粉”中含銀元素;能導電的一定是金屬材料 C.有發光、發熱的現象的就是燃燒;能使石蕊試液變藍的溶液,其溶質一定是堿 D.金剛石不是金屬材料;不飽和溶液通過一定方法變成飽和溶液,質量分數不一定增大 組卷:22引用:1難度:0.9 -
10.非金屬元素具有類似金屬與鹽溶液之間的置換反應規律,即活動性較強的非金屬可把活動性較弱的非金屬從其鹽溶液中置換出來,如在溶液中發生下列反應:Cl2+2NaBr=2NaCl+Br2;Br2+2KI=2KBr+I2;I2+Na2S=2NaI+S↓由此可判斷非金屬的活潑性強弱順序正確的是( )
A.Cl2>I2>Br2>S B.Cl2>Br2>I2>S C.S>I2>Br2>Cl2 D.Cl2>Br2>S>I2 組卷:73引用:5難度:0.7 -
11.為使2008年北京奧運會辦成“綠色奧運會”,某校同學提出下列建議:①開發新清潔能源,減少化石燃料的燃燒;②開發生產無汞電池;③分類回收垃圾;④提倡使用一次性發泡塑料餐具和塑料袋;⑤提倡使用手帕,減少餐巾紙的使用;⑥推廣使用無磷洗滌劑;⑦控制化肥和農藥的過量使用.你認為可以采納的是( )
A.①②③④⑥⑦ B.②③④⑤⑥⑦ C.①②③⑤⑥⑦ D.全部 組卷:23引用:13難度:0.7 -
12.實驗室里保存下列試劑,對其保存的方法和理由的描述均不正確的是( )
編號 試劑 保存方法 理由 A 濃硫酸 保存在密閉的細口瓶中 濃硫酸易吸收空氣中的水分 B 白磷 保存在水中 白磷在空氣中易自燃 C 濃鹽酸 保存在密閉的細口瓶中 濃鹽酸易揮發 D 固體氫氧化鈉 保存在帶橡皮塞的細口瓶中 防止與空氣接氧化 A.A B.B C.C D.D 組卷:9引用:2難度:0.9
四、綜合應用題
-
35.某校化學課外小組的同學利用下圖儀器或裝置做CO還原Fe2O3的實驗(Fe2O3樣品中雜質不參加反應).查閱資料可知:甲酸(HCOOH)通常是一種無色易揮發的液體,它在濃硫酸存在時加熱發生如下反應:HCOOH
CO↑+H2O.濃硫酸
請回答下列問題: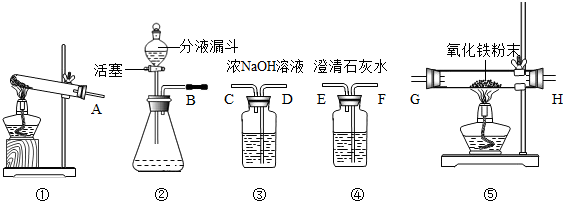
(1)用甲酸滴入濃硫酸的方法制取CO,應選用的發生裝置是(填代號,下同);要除去CO中含有的少量甲酸蒸汽,最好選用上圖中的進行洗氣;檢驗CO還原Fe2O3的氣體產物應選用裝置,需檢驗的氣體應從管口進入.
(2)寫出CO還原Fe2O3的化學方程式.
(3)從開始加熱到實驗結束,Fe2O3粉末的顏色是如何變化的?
(4)CO有毒,如何處理該實驗的尾氣?
(5)利用以上裝置可以測定Fe2O3樣品中Fe2O3的質量分數.測定方法是:取10.0g Fe2O3樣品做實驗,縣稱量樣品和玻璃管的總質量為60.0g,待樣品完全反應并冷卻后,在稱量玻璃管和剩余固體的總質量為57.6g.求該樣品中Fe2O3的質量分數是多少?組卷:43引用:1難度:0.3 -
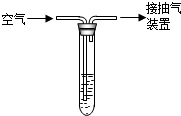 36.硫或含硫物質在空氣中燃燒生成SO2,SO2是一種無色、有刺激性氣味的有毒氣體.
36.硫或含硫物質在空氣中燃燒生成SO2,SO2是一種無色、有刺激性氣味的有毒氣體.
(1)下列環境問題與SO2的排放有關的是.
A.溫室效應 B.酸雨 C.白色污染 D.臭氧空洞
(2)某工廠每天燃燒含硫1%的煤200t,若某煤中的硫全部轉化為SO2,則該工廠每天產生SO2t.向煤中加入石灰石可減少SO2的排放量,在石灰石和氧氣的作用下SO2最終轉化成CaSO4,請寫出有關反應的化學方程式:.
(3)產生SO2的途徑很多.小明在實驗室選取足量鋅與適量的濃硫酸反應制取SO2,反應
的化學方程為:Zn+2H2SO4(濃)=ZnSO4+SO2↑+2H2O,反應一段時間后,老師指出還可能生成另外一種氣體.請根據鋅的化學性質,推斷出此氣體的名稱,并解釋其原因.
(4)我國的環境空氣質量標準中對空氣中SO2最高濃度(單位體積的空氣中所含SO2的質量)限值如下表所示:
為測定某地區空氣中SO2的含量,某環保小組按右圖裝置進行如下實驗:向試管中加入一定量的含碘(I2)1.27mg的碘水,再加入2~3滴淀粉溶液(淀粉遇I2變藍色),通過抽氣裝置抽氣,使空氣有導氣管進入試管與碘水充分接觸,當溶液由藍色變為無色時,恰好完全反應.化學方程式是:SO2+I2+2H2O=H2SO4+2HI.若該實驗中進入試管的空氣總體積為100L.請通過計算說明該地區空氣中SO2的濃度級別.濃度限值(mg/m3) 一級標準 二級標準 三級標準 0.15 0.50 0.70 組卷:12引用:1難度:0.5


