2022-2023學(xué)年山東省濟(jì)南市高三(上)期中化學(xué)試卷
發(fā)布:2024/12/23 9:0:3
一、選擇題:本題共10小題,每小題2分,共20分.每小題只有一個(gè)選項(xiàng)符合題目要求.
-
1.古詩(shī)詞中蘊(yùn)含科學(xué)知識(shí),下列描述錯(cuò)誤的是( )
A.“五果為助,五菜為充”,果蔬中富含豐富的纖維素,對(duì)人體有益 B.“百寶都從海舶來(lái),玻璃大鏡比門(mén)排”,制作玻璃的原材料之一可用于制作光導(dǎo)纖維 C.“獨(dú)憶飛絮鵝毛下,非復(fù)青絲馬尾垂”,鑒別絲和飛絮可用灼燒的方法 D.“紛紛燦爛如星隕,赫赫喧豗似火攻”,煙花利用的“焰色反應(yīng)”屬于化學(xué)變化 組卷:13引用:1難度:0.7 -
2.下列實(shí)驗(yàn)操作錯(cuò)誤的是( )
A.取用金屬鈉時(shí)應(yīng)用鑷子夾取,剩余鈉塊需放回原試劑瓶 B.用濃硫酸干燥二氧化硫和氯化氫 C.金屬鉀失火時(shí)用泡沫滅火器撲滅 D.碘單質(zhì)保存在廣口棕色玻璃試劑瓶中 組卷:8引用:1難度:0.8 -
3.NA代表阿伏加德羅常數(shù)的值.下列說(shuō)法正確的是( )
A.0.1mol?L-1FeCl3溶液中含有的Fe3+數(shù)目小于0.1NA B.25℃,101kPa下,33.6L氫氣中質(zhì)子的數(shù)目為3NA C.100g質(zhì)量分?jǐn)?shù)為64%的CH3OH水溶液中含有的共價(jià)鍵的數(shù)目為14NA D.6.4g銅與足量濃硝酸反應(yīng),產(chǎn)生氣體的分子數(shù)目為0.2NA 組卷:16引用:1難度:0.5 -
4.實(shí)驗(yàn)室配制碳酸鈉標(biāo)準(zhǔn)溶液并用其標(biāo)定鹽酸濃度,下列步驟中所選儀器正確的是( )
A. 
B. 
C. 
D.  組卷:11引用:1難度:0.5
組卷:11引用:1難度:0.5 -
5.某固體混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的若干種物質(zhì)組成,設(shè)計(jì)部分實(shí)驗(yàn)方案探究該固體混合物的成分,所加試劑均過(guò)量,下列說(shuō)法正確的是( )

A.氣體A中一定含有H2 B.固體A中可能含有BaSO4 C.該固體混合物中Fe2O3和Fe至少有其中一種 D.該固體混合物一定含有Na2CO3、Na2SO3、BaCl2 組卷:95引用:3難度:0.3 -
6.下列說(shuō)法錯(cuò)誤的是( )
A.羊毛織品洗后易變形,與氫鍵有關(guān) B.基態(tài)Fe原子中,兩種自旋狀態(tài)的電子數(shù)之比為11:15 C.鍵角:NO3->NH4+>NH3>PH3>P4 D.46g二甲醚(CH3OCH3)中sp3雜化的原子數(shù)為2NA 組卷:37引用:3難度:0.6
三、非選擇題:本題共5小題,共60分.
-
19.某課題組對(duì)含鈷高爐渣(主要成分有Co2O3、Al2O3、Fe3O4、SiO2、CaO、Fe2O3)資源化綜合處理的流程如圖:

回答下列問(wèn)題:
(1)“研磨”的目的為;物質(zhì)A是(填化學(xué)式)。
(2)Co2O3參與“酸浸”的化學(xué)方程式為,“酸浸”過(guò)程實(shí)際消耗雙氧水的量大于理論值,可能的原因是(寫(xiě)出一條即可).濾渣Ⅰ的主要成分是(填化學(xué)式)。
(3)“中和沉淀”中,F(xiàn)e3+生成高效凈水劑黃鈉鐵礬[NaFe3(SO4)2(OH)6]存在于濾渣Ⅱ中.該過(guò)程的離子方程式為。在實(shí)驗(yàn)室中,向Fe(OH)3固體中加入等體積的0.75mol?L-1H2SO4溶液和mol?L-1Na2SO4溶液,使其恰好完全反應(yīng),經(jīng)蒸發(fā)濃縮、冷卻結(jié)晶、過(guò)濾、洗滌、干燥得到黃鈉鐵礬。
(4)濾液③中的鋁元素恰好完全轉(zhuǎn)化為沉淀的pH為。{通常認(rèn)為溶液中離子濃度小于10-5mol-L-1為沉淀完全[Al(OH)4]-+H+?Al(OH)3+H2O;K=1013.38;Ksp[Al(OH)3]=10-33}
(5)CoC2O4經(jīng)充分焙燒質(zhì)量減少2t,則獲得Co3O4的質(zhì)量為t。組卷:58引用:3難度:0.6 -
20.某小組利用數(shù)字化實(shí)驗(yàn)?zāi)M制備Fe(OH)2并探究其相關(guān)性質(zhì)。
Ⅰ.模擬制備Fe(OH)2
裝置如圖:打開(kāi)右瓶上方空氣過(guò)濾器的氣閥(平衡壓強(qiáng),便于FeSO4溶液能夠進(jìn)入右瓶);然后,依次打開(kāi)魯爾閥、推動(dòng)注射器,將注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;當(dāng)右瓶中明顯有白色沉淀生成時(shí),停止加液,依次關(guān)閉魯爾閥、關(guān)閉右瓶上方的空氣過(guò)濾器的氣閥、打開(kāi)左瓶上方的空氣過(guò)濾器的氣閥。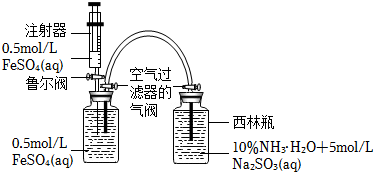
(1)實(shí)驗(yàn)證明制備Fe(OH)2最佳pH是6~8,采用(NH4)2Fe(SO4)2代替FeSO4、氨水代替NaOH溶液效果更好的原因是,Na2SO3的作用是。
Ⅱ:探究原材料FeSO4的相關(guān)性質(zhì)
向50mL蒸餾水中加入FeSO4?7H2O晶體攪拌以加快溶解,用溶解氧傳感器測(cè)定液體中溶解氧濃度隨時(shí)間的變化,b點(diǎn)時(shí)加入NaOH溶液所得曲線如圖。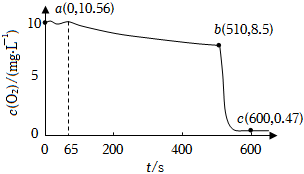
(2)對(duì)比ab、bc段溶解氧的消耗速率,可以得出什么結(jié)論。
(3)已知:在pH≈4時(shí)溶液中,F(xiàn)e2+被氧化成Fe3+的過(guò)程中會(huì)產(chǎn)生FeOOH,且c(Fe2+)降低量大于c(Fe3+)增加量,pH幾乎不變。用總離子方程式說(shuō)明原因,檢驗(yàn)反應(yīng)后的溶液中是否存在Fe2+,可以選擇的試劑是。
A.NaOH溶液
B.K3[Fe(CN)6]
C.KSCN
D.鄰二氮菲
Ⅲ.用鈰量法測(cè)定市售Fe(OH)2中Fe(Ⅲ)的含量
實(shí)驗(yàn)步驟如下:
①取一定量產(chǎn)品溶于稀硫酸中,取待測(cè)液VmL,以二苯胺磺酸鈉作指示劑,用cmol/L硫酸鈰標(biāo)準(zhǔn)溶液進(jìn)行滴定可得出Fe2+的含量。終點(diǎn)時(shí)消耗硫酸鈰標(biāo)準(zhǔn)溶液V1mL,原理如下:2Ce(SO4)2+2FeSO4═Ce2(SO4)3+Fe2(SO4)3。
②取待測(cè)液VmL,溶液中的Fe3+在鹽酸介質(zhì)中用H2(SnCl4)還原成Fe2+,再用HgCl2氧化過(guò)量的H2(SnCl4):2FeCl3+H2(SnCl4)═2FeCl2+H2(SnCl6);H2(SnCl4)+2HgCl2═H2(SnCl6)+Hg2Cl2↓。
(4)重復(fù)①的滴定過(guò)程,終點(diǎn)時(shí)消耗硫酸鈰標(biāo)準(zhǔn)溶液V2mL,待測(cè)液中c(Fe3+)═g/L(用含V、V1、V2的式子表示);若②中加入的氯化亞錫不足,則測(cè)得Fe3+的含量,若沒(méi)有加入氯化高汞則測(cè)得Fe3+的含量。(填“偏高”、“偏低”或“無(wú)影響”)組卷:31引用:1難度:0.3


