蘇教版(2019)必修第二冊《 6.1 化學反應速率與反應限度 》2021年同步練習卷(1)
發布:2024/11/10 6:30:2
一、選擇題
-
1.反應4NH3(g)+5O2(g)═4NO(g)+6H2O(g)在容積為2L的密閉容器中進行,1min后,NH3減少了0.12mol,則平均反應速率表示正確的是( )
A.NO:0.09mol?L-1?min-1 B.H2O:0.12mol?L-1?min-1 C.NH3:0.12mol?L-1?min-1 D.O2:0.075mol?L-1?min-1 組卷:45引用:2難度:0.5 -
2.對于反應A(g)+3B(g)?2C(g)+2D(g),其中反應速率最快的是( )
A.v(D)=0.30mol?L-1?s-1 B.v(C)=0.80mol?L-1?s-1 C.v(B)=0.60mol?L-1?s-1 D.v(A)=0.50mol?L-1?s-1 組卷:41引用:2難度:0.7 -
3.下列關于化學反應速率的說法中正確的是( )
A.對于任何化學反應來說,反應速率越大,反應現象就越明顯 B.化學反應速率通常表示一定時間內任何一種反應物濃度的減少或任何一種生成物濃度的增加 C.化學反應速率為0.8mol/L?s是指1s時某物質的濃度為0.8mol/L D.根據化學反應速率的大小可以知道化學反應進行的快慢 組卷:518引用:5難度:0.4 -
4.關于水煤氣變換反應CO(g)+H2O(g)?CO2(g)+H2(g)△H(簡稱WGS反應),目前普遍接受的表面氧化還原機理的可能基元反應(一步完成的反應)步驟如下:
①H2O+*?H2O*②H2O*+*?OH*+H*③OH*+*?O*+H*④2H*+*?H2+2*⑤CO+*?CO*⑥CO*+O*?CO2*+*⑦CO2*?CO2+*
其中*表示催化劑表面活性位,X*表示金屬表面吸附物種。
WGS反應中可能基元反應步驟的活化能數值(單位:kJ?mol-1)如表:
注:表中X(111)表示不同金屬的同一晶面,110與111表示不同晶面。基元反應 正反應(Ef) 逆反應(Et) Cu(110) Cu(111) Pd(111) Cu(110) Cu(111) Pd(111) ① 0 0 0 58 58 42 ② 96 109 108 24 8 0 ③ 58 67 63 96 88 92 ④ 80 63 92 21 29 8 ⑤ 0 0 0 50 50 142 ⑥ 45 46 100 95 117 140 ⑦ 21 21 17 0 0 0
下列說法正確的是( )A.由表中數據可以得出催化劑通過改變反應的焓變影響反應速率 B.由表中數據可計算Cu(111)催化WGS反應的焓變△H=+44kJ?mol-1 C.由表格數據可以看出Cu(111)的催化效果優于Cu(110) D.該機理中WGS反應的速率控制步驟是② 組卷:9引用:3難度:0.6 -
5.控制變量法是化學實驗的一種常用方法。如表是稀硫酸與某金屬反應的實驗數據,分析上述數據,請判斷下列敘述正確的是( )
實驗
序號金屬質量/g 金屬狀態 /mol?L-1 /mL 溶液溫度/℃ 金屬消失的時間/s 反應前 反應后 1 0.10 粉末 0.5 50 20 35 50 2 0.10 塊狀 0.8 50 20 35 t1 3 0.10 粉末 0.8 50 20 36 25 4 0.10 塊狀 1.0 50 20 35 125 A.t1<125 B.實驗1和3表明,溫度對該反應速率有影響 C.實驗2和3表明,反應物接觸面積對該反應速率有影響 D.實驗中的所有反應,反應前后溶液的溫度變化值(約15℃)相近,推測其原因是反應本質相同 組卷:5引用:2難度:0.7 -
6.硫代硫酸鈉溶液與稀硫酸反應的化學方程式為:Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,下列各組實驗中最先出現渾濁的是( )
實驗 反應溫度/℃ Na2S2O3溶液 稀H2SO4 V/mL c/mol?L-1 V/mL c/mol?L-1 A 25 5 0.1 10 0.1 B 25 5 0.2 10 0.2 C 35 5 0.1 10 0.1 D 35 5 0.2 10 0.2 A.A B.B C.C D.D 組卷:22引用:8難度:0.5
三、元素或物質推斷題
-
17.近年來,研究人員提出利用含硫物質熱化學循環實現太陽能的轉化與存儲。過程如下:
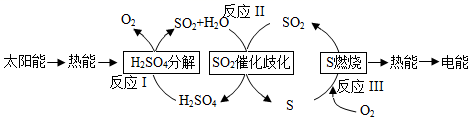
(1)I-可以作為水溶液中SO2歧化反應的催化劑,可能的催化過程如下,將ⅱ補充完整。
ⅰ.SO2+4I-+4H+═S↓+2I2+2H2O
ⅱ.I2+2H2O+═++2I-
(2)探究ⅰ、ⅱ反應速率與SO2歧化反應速率的關系,實驗如下:
分別將18mLSO2飽和溶液加入2mL下列試劑中,密閉放置觀察現象。(已知:I2易溶解在KI溶液中)
①B是A的對比實驗,則a=序號 A B C D 試劑組成 0.4mol?L-1KI amol?L-1KI 0.2mol?L-1H2SO4 0.2mol?L-1KI
0.0002molI2實驗現象 溶液變黃,一段時間后出現渾濁 溶液變黃,出現渾濁較A快 無明顯現象 溶液由棕褐色很快褪色,變為黃色,出現渾濁較A快 。
②比較A、B、C,可得出的結論是。
③實驗表明,SO2的歧化反應速率D>A。結合ⅰ、ⅱ反應速率解釋原因:。組卷:23引用:2難度:0.9
四、原理綜合題
-
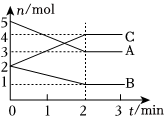 18.(1)一定溫度下,2L容器內某反應中A、B、C的物質的量隨反應時間的變化情況如圖所示,則該反應的化學方程式為:;2分鐘后A、B、C各物質的量不再隨時間的變化而變化,說明在這個條件下,反應已達到了;2min內C的平均反應速率為。
18.(1)一定溫度下,2L容器內某反應中A、B、C的物質的量隨反應時間的變化情況如圖所示,則該反應的化學方程式為:;2分鐘后A、B、C各物質的量不再隨時間的變化而變化,說明在這個條件下,反應已達到了;2min內C的平均反應速率為。
(2)已知拆開1molH-H鍵、1molO=O鍵、1molH-O鍵分別需要吸收的能量為436kJ、498kJ、463kJ。則2H2+O2=2H2O反應生成1molH2O需要(填“放出”或“吸收”)kJ的熱量;為了加快2H2+O2=2H2O的反應速率,可以采取的措施有(填序號)
A.使用催化劑
B.適當提高氧氣的濃度
C.適當提高反應的溫度
D.適當降低反應的溫度組卷:17引用:2難度:0.9


