2023年重慶市南開中學高考化學三診試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共14小題,每小題3分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.向下列物質中加入NaOH溶液并加熱,其成分不發生改變的是( )




A.用聚四氟乙烯制成的實驗儀器 B.用于通信的光導纖維 C.用于焙制糕點的小蘇打 D.從餐廚廢棄物中提取的地溝油 A.A B.B C.C D.D 組卷:28引用:3難度:0.7 -
2.“結構決定性質,性質決定用途”。下列物質的性質與用途不具有對應關系的是( )
A.氮化硅耐高溫、抗氧化,可用于制造高溫結構陶瓷 B.氯化鐵溶液顯酸性,可用于刻蝕銅制電路板 C.硬鋁的密度小、強度高,可用于制造飛機外殼 D.聚乳酸具有生物相容性和可降解性,可用作手術縫合線 組卷:24引用:3難度:0.6 -
3.室溫下,下列各組微粒在指定溶液中可能大量共存的是( )
A.無色透明的水溶液中:K+、Na+、 Cr2O2-7B.硝酸型酸雨的雨水中: 、Fe2+、NH+4SO2-4C.加入金屬Al產生H2的水溶液中:K+、 、SO2-4NO-3D.水電離的H+濃度為1×10-12mol/L的水溶液中:CH3OH、K+、 MnO-4組卷:95引用:3難度:0.6 -
4.白銅是一種延展性好、硬度高、色澤美觀、耐腐蝕的合金材料,其主要成分為Cu、Ni、Zn,還含有少量S、P、As等元素。關于上述涉及到的元素,下列說法正確的是( )
A.基態Ni原子的簡化電子排布式為:3d84s2 B.基態As原子最高能級的軌道形狀為啞鈴形 C.第一電離能:S>P>Cu D.S、P為p區元素,Cu、Zn為d區元素 組卷:32引用:2難度:0.5 -
5.2023年4月3日,沙坪壩區公安分局民警走進重慶南開中學校園,舉辦了包括刑偵、網安、禁毒、反恐等主題的安全教育活動。學生們在禁毒教育中認識了以氯胺酮、四氫大麻酚等(結構如圖所示)為主要原料的毒品對人體與社會的危害。下列說法正確的是( )
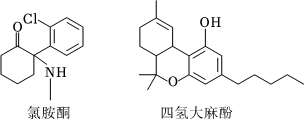
A.氯胺酮的分子式為C12H13NOCl B.四氫大麻酚中只有1個手性碳原子 C.氯胺酮和四氫大麻酚均可以發生取代、加成、氧化、消去反應 D.1mol四氫大麻酚與濃溴水反應,最多可以消耗3molBr2 組卷:32引用:2難度:0.6 -
6.R、W、X、Y、Z為原子序數依次增大的短周期元素且位于三個不同的周期。
、XR+4、ZR4三種微粒的空間構型相同,W與Z同主族。下列說法正確的是( )YR-4A.氫化物的沸點:X>Z>W B.原子半徑:Y>Z>X>R C.最高價氧化物對應水化物的酸性:X>W>Y>Z D.Z與W形成的二元化合物,其晶體熔點比Z單質晶體低 組卷:22引用:1難度:0.5
二、非選擇題:共58分。
-
17.工業生產中產生的煙氣中常含有氮氧化物NOx,為了防止污染大氣,排放前需要經過適當處理脫除NOx。
(1)在一定條件下,可用CO還原NO,其原理為:2CO(g)+2NO(g)?2CO2(g)+N2(g)。
已知:標準摩爾生成焓指標準狀態下由最穩定的單質合成1mol該物質的焓變。一些物質的燃燒熱或標準摩爾生成焓如下表所示。
①2CO(g)+2NO(g)?2CO2(g)+N2(g)ΔH=物質 C(s) CO(g) NO(g) 燃燒熱ΔH(kJ/mol) -393.5 標準摩爾生成焓ΔfHmθ(kJ/mol) 0 -110.5 +90.5 。
②下列措施能夠同時提高上述反應的速率和NO平衡轉化率的是(填標號)。
A.使用催化劑
B.及時分離生成的CO2
C.升高溫度
D.提高CO的濃度
③一定溫度下,在體積恒為2L的密閉容器中通入CO與NO各2mol,初始壓強為20kPa。僅發生上述反應,達到平衡后,c(NO):c(N2)=2:1,則此溫度下該反應的壓強平衡常數Kp=kPa-1。再向容器中通入2molCO2和1molN2,達到新的平衡時,混合氣體中NO的體積分數相比原平衡(選填“增大”、“減小”或“不變”)。
(2)CO也可以還原NO2,反應原理為:NO2(g)+CO(g)═NO(g)+CO2(g)。
研究發現,該反應分兩步進行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g)(慢反應)
第二步:NO3(g)+CO(g)→NO2(g)+CO2(g)(快反應)
已知:此條件下,該反應的化學反應速率v=k?c(NO2)(k為速率常數,只與溫度有關)。
下列分析正確的是(填標號)。
A.增大NO2濃度,該反應速率增大
B.增大CO濃度,該反應速率幾乎不變
C.NO3是該反應的催化劑
D.第一步反應的活化能小于第二步反應
(3)工業煙氣中的NO2常常無法完全脫除,可用如圖所示裝置來測定工業煙氣中NO2的脫除率,其原理如下: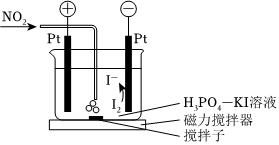
測定開始前,電解質溶液中=n。測定時,將含NO2的煙氣中通入電解質溶液中使NO2與I-反應NO2被還原為NO,煙氣中其他成分均不參與反應)。此時電解池自動開始工作,直到c(I2)c(I-)重新變為n,電解自動結束。c(I2)c(I-)
①裝置工作時,陰極反應的電極反應式為:,NO2被I-還原的離子方程式為。
②將某工業煙氣分為等體積的兩份,其中一份直接通入該裝置,另一份脫除部分NO2后再通入該裝置,兩次電解過程中轉移的電子量分別為amol、bmol,則本次NO2脫除率為。組卷:24引用:1難度:0.5 -
18.氮雜環丁烷-2-羧酸(G)是一種重要的化合物,常用于合成抗體-藥物結合物(ADC)。其合成路線如圖(Ph為苯基):
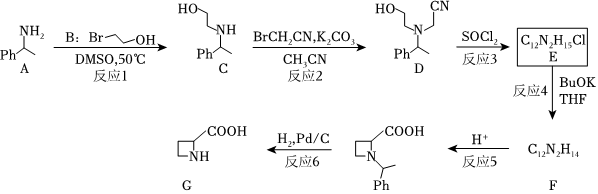
(1)化合物B的系統命名為:,D中含有的含氧官能團為(填名稱)。
(2)反應2和反應6的反應類型分別為、。
(3)反應3生成一種有刺激性氣味的氣體,寫出該反應的化學方程式:。
(4)化合物F的結構簡式為。
(5)分子式比G少一個氧原子的化合物H滿足下列條件的同分異構體有種(不考慮立體異構)。
a.能發生水解反應
b.不含有三元環狀結構
c.不含有C=N的結構
(6)反應4中,除了得到F外,還得到了一種含有八元環結構的化合物M,其分子式為C24N4H28,畫出其結構簡式:。組卷:21引用:1難度:0.3


