2021-2022學年云南省大理州巍山二中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共24小題,每小題2分,共48分。在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.下列變化發生后,反應體系能量降低的是( )
A.水與Na2O2反應 B.碳與CO2的反應 C.Cl2→2Cl D.干冰氣化 組卷:5引用:3難度:0.8 -
2.下列有關化學用語使用正確的是( )
A.N2的電子式: 
B.鐵紅的化學式:Fe(OH)3 C.H2O2的電子式: 
D.中子數為20的氯原子: Cl2017組卷:16引用:1難度:0.7 -
3.在中和熱測定的實驗中不需要用到的儀器是( )
A.量筒 B.溫度計 C.環形玻璃攪拌棒 D.天平 組卷:71引用:25難度:0.9 -
4.下列說法中錯誤的是( )
A.食品袋中的抗氧化劑能延緩食品變質 B.對于同一物質在不同狀態時的熵值是:氣態>液態>固態 C.平衡常數K值越大,則可逆反應進行越完全,反應物的轉化率越大 D.凡是能量達到活化能的分子發生的碰撞均為有效碰撞 組卷:14引用:3難度:0.7 -
5.下列有關物質的性質與用途具有對應關系的是( )
A.SO2具有氧化性,可用于漂白紙漿 B.NH4HCO3受熱易分解,可用作氮肥 C.Fe2(SO4)3易溶于水,可用作凈水劑 D.Al2O3熔點高,可用作耐高溫材料 組卷:1284引用:35難度:0.9 -
6.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.無色透明的溶液中:Fe3+、Mg2+、SCN-、Cl- B.c(Fe2+)=1 mol?L-1的溶液中:K+、NH4+、MnO4-、SO42- C. =1×10 -12的溶液中:K+、Na+、CO32-、NO3-c(H+)c(OH-)D.能使甲基橙變紅的溶液中:Na+、NH4+、SO42-、HCO3- 組卷:39引用:4難度:0.8 -
7.阿伏加德羅常數的值為NA。下列說法正確的是( )
A.0.1mol的11B中,含有0.6NA個中子 B.0.02mol/LH2SO4的溶液中,所含H+數為0.04NA C.標準狀況下,2.24LN2和O2的混合氣體中分子數為0.2NA D.將0.2molSO2和0.1molO2置于密閉容器中充分反應后,其分子總數為0.2NA 組卷:6引用:1難度:0.5 -
8.某已平衡的化學可逆反應,下列有關敘述正確的是( )
A.使用合適的催化劑可以使平衡正向移動 B.升高溫度,平衡一定正向移動 C.增加生成物的質量,平衡一定逆向移動 D.有氣體參加的可逆反應,減小體積增大壓強能夠加快反應速率 組卷:58引用:7難度:0.5 -
9.乙酸橙花酯是一種食用香料,其結構簡式如圖,它含有的官能團有( )

A.1種 B.3種 C.4種 D.2種 組卷:42引用:3難度:0.7 -
10.接觸法制硫酸工藝中,其主反應如下:2SO2(g)+O2(g)?2SO3(g)△H=-197 kJ/mol,下列說法正確的是( )
A.因為反應放熱,所以該反應不需要加熱即能快速反應 B.增大O2的濃度可以提高反應速率和SO2的轉化率 C.反應450℃時的平衡常數小于500℃時的平衡常數 D.恒溫下縮小容器容積,使Q>K 組卷:26引用:8難度:0.6
二、填空題(本大題共6小題,共52分)
-
29.某鋰電池的反應式為FePO4+Li
LiFePO4,回答下列問題:放電充電
(1)該蓄電池放電過程中發生還原反應的物質是(寫化學式),充電時外電路中轉移了2mol電子,則陰極產物的質量為g。
(2)若以該鋰電池為電源,電解NaOH稀溶液,制備H2和O2,則陽極的電極反應式為。
(3)若利用該電源精煉銅,粗銅精煉過程中,因陽極雜質逐漸溶解,電解質溶液中Fe2+、Zn2+的濃度會逐漸增大,而這些雜質離子則會影響后續精煉。某同學設計如圖所示的除雜方案: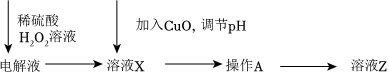
已知有關氫氧化物沉淀的pH如表:
加入H2O2溶液時發生反應的離子方程式為氫氧化物 Fe(OH)3 Cu(OH)2 Zn(OH)2 Fe(OH)2 開始沉淀時的pH 2.3 5.6 6.2 7.5 完全沉淀時的pH 3.9 6.4 8.0 9.7 ;若要檢驗Fe2+是否完全轉化為Fe3+,可選擇的試劑是,對應現象是;調節pH=5.0時,則沉淀的離子主要是(填離子符號);操作A的名稱是;該同學的方案中未除去的雜質金屬陽離子是。組卷:6引用:2難度:0.5 -
30.用合成氣生成甲醇的反應為CO(g)+2H2(g)?CH3OH(g)△H,在10L恒容密閉容器中按物質的量之比1:2充入CO和H2,測得CO的平衡轉化率與溫度和壓強的關系如圖所示,200℃時n(H2)隨時間的變化如表所示:
t/min 0 1 3 5 n(H2)/mol 8.0 5.4 4.0 4.0 
(1)△H(填“>”“<”或“=”) 0。
(2)下列說法正確的是(填序號)。
A.溫度越高,該反應的平衡常數越大
B.達到平衡后再充入稀有氣體,CO的轉化率提高
C.容器內氣體壓強不再變化時,反應達到最大限度
D.圖中壓強:p1<p2
(3)0~3min內用CH3OH表示的反應速率v(CH3OH)=mol?L-1?min-1。
(4)200℃時,該反應的平衡常數K=。向上述200℃達到平衡的恒容密閉容器中再加入2molCO、2molH2、2molCH3OH,保持溫度不變,則反應(填“正向”或“逆向”)進行。組卷:47引用:3難度:0.5


