2020-2021學年北京市豐臺區高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.如圖設備工作時,將化學能轉化為電能的是( )
A. 
煤氣灶B. 
鉛蓄電池C. 
太陽能熱水器D. 
風力發電組卷:35引用:2難度:0.8 -
2.下列物質中,屬于強電解質的是( )
A.NaNO3 B.NH3?H2O C.H2O D.H2CO3 組卷:27引用:2難度:0.6 -
3.向水中加入下列溶質,能促進水電離的是( )
A.H2SO4 B.NaOH C.NaCl D.NH4Cl 組卷:86引用:3難度:0.8 -
4.下列溶液一定顯酸性的是( )
A.c(H+)>c(OH-) B.含有H+ C.pH<7 D.酚酞變紅 組卷:55引用:6難度:0.8 -
5.下列事實與鹽類水解無關的是( )
A.Na2CO3溶液顯堿性 B.實驗室配制FeSO4溶液時,加少量鐵粉 C.向沸水中滴入飽和FeCl3溶液制Fe(OH)3膠體 D.用NaHCO3與Al2(SO4)3制作泡沫滅火器 組卷:42引用:1難度:0.7 -
6.下列關于有機化合物
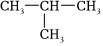 的說法,不正確的是( )
的說法,不正確的是( )A.屬于烷烴 B.名稱為2-甲基丙烷 C.一氯取代產物有4種 D.與乙烷互為同系物 組卷:147引用:2難度:0.8
三、解答題(共4小題,滿分49分)
-
18.氨在能源、化肥生產等領域有著非常重要的用途。
(1)與H2-O2燃料電池相比,氨易液化,運輸和儲存方便,安全性能更高。新型NH3-O2燃料電池原理如圖1所示。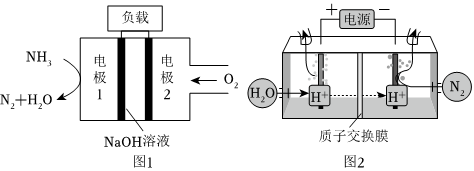
①電極1為(填“正極”或“負極”),電極2的反應式為。
②氨氣也可以在純氧中燃燒,此時化學能轉化為熱能。
已知:2H2(g)+O2(g)═2H2O(g)ΔH1
N2(g)+3H2(g)?2NH3(g)ΔH2
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)ΔH3
ΔH1、ΔH2、ΔH3之間的關系式為:ΔH3。
③與熱能相比,電能具有更高的利用價值,燃料電池可將化學能直接轉化為電能的原因是。
(2)氨的合成是當前的研究熱點,目前最主要的方法是Haber-Bosch法:通常用以鐵為主的催化劑在400~500℃和10~30MPa的條件下,由氮氣和氫氣直接合成氨。
①該反應放熱,但仍選擇較高溫度。其原因是。
②列舉一條既能提高速率又能提高原料轉化率的措施。
(3)常溫常壓下電解法合成氨的原理如圖2所示。
①陽極產生的氣體是。
②陰極生成氨的電極反應式為。
③經檢測在陰極表面發生了副反應,導致氨的產量降低。寫出該副反應的電極反應式。
④為了盡可能避免副反應的發生,采用的方法是改進陰極表面的催化劑,這樣設計是利用了催化劑具有性。組卷:21引用:2難度:0.6 -
19.去除泥沙后的粗鹽溶液中含有Mg2+、Ca2+和
等雜質離子,獲取精制食鹽水的流程如圖。SO2-4
(1)過程Ⅰ,加入NaOH的目的是為了除去Mg2+,離子方程式為。
(2)過程Ⅱ,試劑a是。
(3)過程Ⅱ,如果不過濾,直接向渾濁液中加入過量Na2CO3,則最終獲得的精制食鹽水中含有一定量的,結合化學用語解釋原因SO2-4。
(4)過程Ⅳ,調節pH所用的酸為(填寫化學式)。已知碳酸溶液中含碳微粒的物質的量分數隨pH變化如圖所示,調節溶液pH═7(填“可行”或“不可行”),理由是。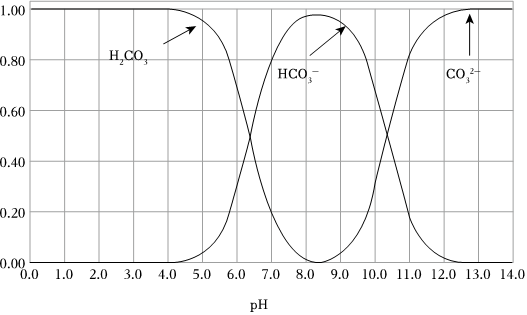
(5)判斷雜質是否除盡是粗鹽精制的關鍵環節,過程Ⅰ中當c(Mg2+)≤10-5mol?L-1時,可認為Mg2+被除盡。(已知:Mg(OH)2,Ksp=5.6×10-12mol3?L-3)
常溫下當加入NaOH使溶液pH═11時,c(Mg2+)=mol?L-1,此時溶液中Mg2+。(填“已除盡”或“未除盡”)組卷:22引用:1難度:0.6


