2021-2022學年北京市民大附中高三(上)月考化學試卷(12月份)
發布:2024/4/20 14:35:0
一、選擇題,共14題,每題3分,共42分。在列出的四個選項中,選出最符合題目要求的一項。
-
1.可回收物經綜合處理,可再利用,節約資源。下列可回收物的主要成分屬于合金的是( )




A.舊自行車鋼圈 B.舊報紙 C.舊塑料盆 D.舊衣物 A.A B.B C.C D.D 組卷:82引用:3難度:0.9 -
2.下列反應過程,與氧化還原反應無關的是( )
A.在鋼鐵設備上連接金屬Zn保護鋼鐵 B.向工業廢水中加入Na2S去除其中的Cu2+、Hg2+ C.向煤中加入適量石灰石轉化為CaSO4減少SO2排放 D.補鐵劑(含琥珀酸亞鐵)與維生素C同服促進鐵的吸收 組卷:28引用:2難度:0.8 -
3.2019年,我國青年化學家雷曉光被遴選為“青年化學家元素周期表”氮元素的代言人。下列與氮元素有關的說法正確的是( )
A.14N與14C互為同位素 B.-NH2的電子式為 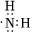
C.NH3的熱穩定性比HF的強 D.Si3N4中N為+3價 組卷:57引用:3難度:0.8 -
4.下列各離子組在指定的溶液中能夠大量共存的是( )
A.無色溶液中:Cu2+、K+、SCN-、Cl- B.含有 的溶液中:I-、NO-3、SO2-3、H+SO2-4C.由水電離出的c(H+)=1.0×10-13 mol?L-1的溶液中:Na+、 、NH+4、SO2-4HCO-3D.pH=11的NaOH溶液中: 、K+、CO2-3、NO-3SO2-4組卷:117引用:17難度:0.6 -
5.利用元素周期表的知識,判斷下列對于鈹及其化合物的性質預測不正確的是( )
A.原子半徑:Be>B B.Be能與冷水劇烈反應 C.相同條件下,Li比Be容易與酸反應 D.最高價氧化物對應水化物的堿性:Ca(OH)2>Be(OH)2 組卷:73引用:2難度:0.6 -
6.有機化合物X(HOCH2CH=CHCH2OH)主要用于殺蟲劑、農業化學品和維生素B6的中間體。關于X的下列說法不正確的是( )
A.存在順反異構 B.可發生加成、取代、加聚反應 C.熔沸點低于CH3CH=CHCH3 D.核磁共振氫譜有3種類型氫原子吸收峰 組卷:18引用:3難度:0.6
二、非選擇題(共58分)
-
19.含有K2Cr2O7的廢水具有較強的毒性,工業上常用鋇鹽沉淀法處理含有K2Cr2O7的廢水并回收重鉻酸,具體的流程如下:

已知:CaCr2O7、BaCr2O7易溶于水,其它幾種鹽在常溫下的溶度積常數如下表所示。
(1)用離子方程式表示K2Cr2O7溶液中同時存在K2CrO4的原因(將離子方程式補充完整):1Cr2O72-+物質 CaSO4 CaCrO4 BaCrO4 BaSO4 溶度積 9.1×10-6 2.30×10-2 1.17×10-10 1.08×10-10 =CrO42-+。
(2)向濾液1中加入BaCl2?2H2O的目的,是使CrO42-從溶液中沉淀出來。
①結合上述流程說明熟石灰的作用:。
②結合表中數據,說明選用Ba2+而不選用Ca2+處理廢水的理由:。
③研究溫度對CrO42-沉淀效率的影響。實驗結果如下:在相同的時間間隔內,不同溫度下CrO42-的沉淀率,如圖1所示。(沉淀率=固體2中CrO2-4的量濾液1中CrO2-4的量×100%)
已知:BaCrO4(s)?Ba2+(aq)+CrO42-(aq)△H>0CrO42-的沉淀效率隨溫度變化的原因是。
(3)向固體2中加入硫酸,回收重鉻酸。
①硫酸濃度對重鉻酸的回收率如圖2所示。結合化學平衡移動原理,解釋使用0.450mol/L的硫酸時,重鉻酸的回收率明顯高于使用0.225mol/L的硫酸的原因:。
②回收重鉻酸的原理如圖3所示。當硫酸濃度高于0.450mol/L時,重鉻酸的回收率沒有明顯變化,其原因是。
(4)綜上所述,沉淀BaCrO4并進一步回收重鉻酸的效果與有關。組卷:35引用:3難度:0.4 -
 20.某小組同學探究Cu和H2O2的反應。
20.某小組同學探究Cu和H2O2的反應。
【猜想預測】
猜想1:Cu與H2O2不發生反應;
猜想2:Cu與H2O2可能發生氧化還原反應,H2O2作氧化劑。
【實驗探究】
實驗ⅰ:向裝有0.5g Cu的燒杯中加入20mL 30% H2O2溶液,一段時間內無明顯現象,10小時后,溶液中有少量藍色渾濁,Cu片表面附著少量藍色固體。
(1)通過該實驗證明了猜想2成立,寫出該反應的化學方程式:。
【繼續探究】
針對該反應速率較慢,小組同學查閱資料,設計并完成了下列實驗。
資料:Cu2++4NH3?[Cu(NH3)4]2+,[Cu(NH3)4]2+為深藍色;Cu(OH)2可溶于氨水形成深藍色溶液。
(2)實驗ⅱ中:溶液變藍的原因是裝置 序號 試劑a 現象 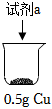
ⅱ 20mL 30% H2O2與4mL 5mol/L H2SO4混合液 Cu表面很快生產少量氣泡,溶液逐漸變藍,產生較多氣泡 ⅲ 20mL 30% H2O2與4mL 5mol/L氨水混合液 溶液立即變為深藍色,產生大量氣泡,Cu表面有少量藍色不溶物 (用化學用語解釋);經檢驗產生的氣體為氧氣,產生氧氣的原因是。
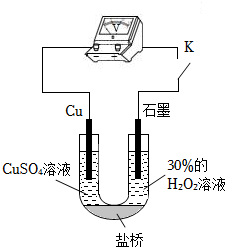
(3)對比實驗ⅰ和ⅲ,為探究氨水對Cu的還原性或H2O2氧化性的影響,該同學利用如圖裝置繼續實驗。
已知:電壓大小反映了物質氧化還原性強弱的差異;物質氧化性與還原性強弱差異越大,電壓越大。
a.K閉合時,電壓為x。
b.向U型管右側溶液中滴加氨水后,電壓不變。
c.繼續向U型管左側溶液中滴加氨水后,電壓增大了y。
該實驗的結論:。利用該方法也可證明酸性增強可提高H2O2的氧化性,導致Cu溶解速率加快。
(4)對比實驗ⅱ和ⅲ,實驗ⅲ中產生氧氣速率明顯更快,可能的原因是。
(5)實驗ⅲ有少量藍色不溶物,小組同學加入少量NH4Cl可使其溶解,結合文字和化學用語解釋不溶物溶解的原因:。
(6)基于以上實驗,影響Cu與H2O2反應速率的因素有。組卷:51引用:5難度:0.4


