2021-2022學年遼寧省朝陽育英高考補習學校高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一.選擇題(本題包括15小題,每小題3分,共45分。每小題只有一個選項符合題意。)
-
1.“碳中和”是指企業、團體或個人測算在一定時間內直接或間接產生的溫室氣體排放總量,然后通過植樹造林、節能減排等形式,抵消自身產生的排放量,實現CO2“零排放”。下列措施不能實現“碳中和”的是( )
A.提倡用共享單車出行 B.發展CO2捕集技術 C.燃煤中加入石灰石 D.開發新能源替代化石燃料 組卷:14引用:2難度:0.6 -
2.下列物質的結構與組成表示方法錯誤的是( )
A.HClO 的結構式:H-O-Cl B.硫離子的結構示意圖 
C.二硫化碳的電子式 
D.中子數為10的氧原子:16O 組卷:13引用:4難度:0.7 -
3.NA為阿伏加德羅常數的值。下列說法正確的是( )
A.Na2O2與足量的水反應生成1molO2,轉移電子數目為2NA B.電解飽和食鹽水時,每得到1molNaOH,在陽極上反應的離子就得到1mol電子 C.100mL1mol?L-1FeCl3溶液中含有Fe3+數目為0.1NA D.將2molSO2和1molO2充分反應,轉移的電子數目為4NA 組卷:7引用:1難度:0.6 -
4.下列反應的離子方程式正確的是( )
A.足量的CO2通入飽和碳酸鈉溶液中:CO2+CO32-+H2O═2HCO3- B.向FeBr2溶液中通入等物質的量的氯氣:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- C.向Ba(NO3)2溶液中通過量的SO2:2Ba2++2NO3-+3SO2+2H2O═2BaSO4↓+SO42-+NO↑+4H+ D.硫代硫酸鈉與稀硫酸反應:S2O32-+6H++2SO42-═4SO2↑+3H2O 組卷:14引用:1難度:0.6 -
5.下列有關晶體性質的比較正確的是( )
A.熔點:金剛石>晶體硅>碳化硅 B.沸點:NH3>H2O>HF C.硬度:白磷>冰>二氧化硅 D.熔點:SiI4>SiBr4>SiCl4 組卷:73引用:9難度:0.6 -
6.下列實驗操作、現象和結論都正確且有相關性的是( )
選項 操作 現象 結論 A 向某溶液中滴加稀NaOH溶液,將濕潤紅色石蕊試紙置于試管口 試紙不變藍色 原溶液中沒有NH4+ B 向某溶液中滴加幾滴KSCN溶液 溶液變紅 溶液中不可能含Fe2+ C 向新制氯水中滴加幾滴紫色石蕊試液 溶液先變紅后褪色 新制氯水具有酸性和強氧化性 D 在Na2SO3飽和溶液中滴加稀硫酸,將產生的氣體通入KMnO4溶液中 KMnO4溶液褪色 該氣體產物具有漂白性 A.A B.B C.C D.D 組卷:19引用:4難度:0.5 -
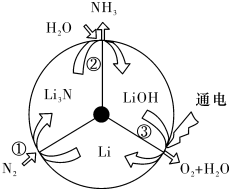 7.一種新型的合成氨的方法如圖所示。下列說法正確的是( )
7.一種新型的合成氨的方法如圖所示。下列說法正確的是( )A.反應①中N2發生了氧化反應 B.反應①和②均屬于“氮的固定” C.反應③為4LiOH 4Li+2H2O+O2↑通電D.三步循環的總結果為N2+3H2?2NH3 組卷:114引用:15難度:0.6
二、填空題(共55分)
-
21.草酸晶體的組成可表示為H2C2O4?xH2O,通過下列實驗測定x值,步驟如下:
①稱取6.30g草酸晶體配成100mL水溶液。
②取25.00mL所配草酸溶液置于錐形瓶中,加入適量稀硫酸,用0.5000mol?L-1KMnO4溶液進行滴定,到達滴定終點時,消耗KMnO4溶液10.02mL。
③重復②步驟2次,消耗KMnO4溶液的體積分別為11.02mL和9.98mL。
(1)滴定終點的判斷是。
(2)根據以上實驗數據,計算x值,x=。組卷:0引用:1難度:0.7 -
22.國內外目前生產苯乙烯的方法主要是乙烯脫氫法,反應原理為

(1)已知:部分化學鍵的鍵能數據如表所示:
則ΔH1=共價鍵 C-C C-H C=C H-H 鍵能/(kJ?mol-1) 347.7 413.4 615 436 。
(2)實際生產過程中,通常向乙苯中摻入水蒸氣,保持體系總壓為常壓(101kPa)的條件下進行反應、乙苯的平衡轉化率與溫度、投料比m[m=]的關系如圖1所示。n(乙苯)n(H2O)
①摻入水蒸氣的目的是。
②投料比(m1、m2、m3)由大到小的順序為。
③若投料比m=1:9,反應溫度為600℃,并保持體系總壓為常壓的條件下進行反應,下列事實不能作為該反應達到平衡的依據的是(填字母)。
a、v正(乙苯)=v逆(苯乙烯)
b、容器內氣體密度不再變化
c、容器內氣體的平均相對分子質量不再變化
d、苯乙烯的體積分數不再變化
e、容器內苯乙烯與H2的物質的量之比不再變化
④若m2=1:9,保持體系總壓為常壓(101kPa),則A點溫度下,該反應的平衡常數Kp=kPa(列出計算式即可,Kp為用平衡分壓代替平衡濃度表示的平衡常數,分壓=總壓×物質的量分數);若其他條件不變,將A點對應起始反應物置于某恒容密閉容器中,則乙苯的平衡轉化率(填“>”“<”或“=”)60%。
(3)近年來,用CO2作為溫和氧化劑,選擇性氧化乙苯制苯乙烯的綠色反應體系不斷取得新進展,在O2氣氛下,乙苯脫氫反應可能存在一步法和二步法兩種途徑,如圖2所示。
則 ,反應的平衡常數K3=(用含K1、K2的代數式表示)。組卷:4引用:1難度:0.4
,反應的平衡常數K3=(用含K1、K2的代數式表示)。組卷:4引用:1難度:0.4


