2021-2022學年江蘇省南通市海門中學高二(上)月考化學試卷(10月份)
發布:2024/4/20 14:35:0
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.根據事物的某些相似性質類推其他的相似性,并預測類似的可能性,是我們經常使用的一種思維方法。以下推論正確的是( )
選項 實際事實 類推結果 A 酸中都含有氧元素 含有氧元素的化合物都是酸 B 飽和溶液不能繼續溶解某種溶質 飽和溶液也不能繼續溶解其他溶質 C 氫氧化鈉溶液中有OH-,能與酸反應 氫氧化鉀溶液也有OH-,也能與酸反應 D 酸與堿發生中和反應生成鹽和水 生成鹽和水的反應都是中和反應 A.A B.B C.C D.D 組卷:44引用:4難度:0.8 -
2.下列離子方程式正確的是( )
A.向明礬溶液中逐滴滴入Ba(OH)2溶液,至沉淀質量最大時反應的離子方程式為:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ B.向碳酸氫鎂溶液中加入過量的NaOH溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O C.向含1mol FeBr2的溶液中通入標準狀況下22.4LCl2時,發生的反應為:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- D.向NaHSO4溶液中滴入Ba(OH)2溶液至恰好顯中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ 組卷:31引用:4難度:0.7 -
3.實驗室制備NaClO2的裝置如圖,其中C裝置內生成ClO2。下列說法錯誤的是( )
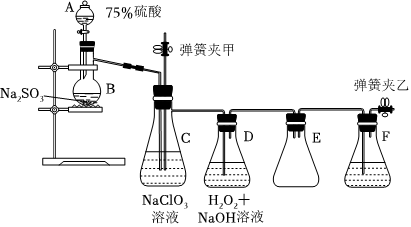
A.實驗開始時,應打開彈簧夾甲,保持壓強平衡 B.F中的試劑可用濃NaOH溶液 C.H2O2是制備NaClO2反應的還原劑 D.用98.3%硫酸代替75%硫酸,產生SO2的速率更快 組卷:13引用:4難度:0.4 -
4.化學與生活息息相關。下列說法錯誤的是( )
A.NaCl可用作食品防腐劑 B.純堿可用于治療胃酸過多 C.甘油具有護膚保濕作用 D.地溝油可用于制肥皂 組卷:30引用:2難度:0.9 -
5.消毒劑在生產生活中有極其重要的作用,開發具有廣譜、高效、低毒的殺菌劑和消毒劑是今后發展的趨勢,下列敘述錯誤的是( )
A.等物質的量的四種消毒劑(Cl2、H2O2、ClO2(還原產物為Cl-)、O3(1mol O3轉化為1mol O2和1mol H2O)消毒效率最高的是O3 B.H2O2作氧化劑時產物沒有污染性,故有“綠色氧化劑”的美稱 C.漂白劑亞氯酸鈉(NaClO2)在酸性條件下轉化為亞氯酸,易發生反應:HClO2→ClO2↑+H++Cl-+H2O(未配平)。在該反應中,當有1mol ClO2生成時轉移的電子數約為6.02×1023 D.“84”消毒液和潔廁劑不能混用,原因是ClO-+Cl-+2H+═Cl2↑+H2O 組卷:30引用:4難度:0.5 -
6.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.0.1L0.5mol/L乙醇溶液中含有的氧原子數為0.05NA B.將4.6g鈉用鋁箱包裹并刺小孔,與足量水充分反應,生成的H2分子數為0.1NA C.C2H4O與C2H6O2的混合物0.1mol,充分燃燒消耗O2的數目為0.25NA D.常溫常壓下,22.4LHF所含的分子數目為NA 組卷:33引用:4難度:0.5
二、填空題(共58分)
-
17.“84消毒液”能有效殺滅甲型H1N1病毒,某同學購買了一瓶“威露士”牌“84消毒液”,該消毒液通常稀釋100倍(體積比)使用。查閱相關資料和消毒液包裝說明得到如下信息:
(1)該“84消毒液”的物質的量濃度約為84消毒液
有效成分 NaClO
規格 1000mL
質量分數 25%
密度 1.19g/cm3mol?L-1。
(2)某同學取100mL該“84消毒液”,稀釋后用于消毒,稀釋后的溶液中c(Na+)=mol?L-1。
(3)該同學參閱該“84消毒液”的配方,欲用NaClO固體配制480mL含NaClO質量分數為25%的消毒液。下列說法正確的是(填字母)。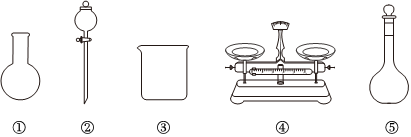
A.如圖所示的儀器中,有三種是不需要的,還需要一種玻璃儀器
B.容量瓶用蒸餾水洗凈后,應烘干后才能用于溶液配制
C.利用購買的商品NaClO來配制可能導致結果偏低
D.需要稱量NaClO固體的質量為142.8g
(4)取用任意體積的該鹽溶液時,下列物理量中會隨所取體積的多少而變化的是(填字母)。
A.溶液中NaClO的摩爾質量
B.溶液的濃度
C.溶液中NaClO的物質的量
D.溶液的密度
(5)一瓶上述“威露士”牌“84消毒液”能吸收空氣中L的CO2(標準狀況)而變質。(已知:CO2+NaClO+H2O═NaHCO3+HClO)
(6)“84消毒液”與稀硫酸混合使用可增強消毒能力,某消毒小組人員用98%(密度為1.8g?cm-3)的濃硫酸配制100mL物質的量濃度為0.8mol?L-1的稀硫酸用于增強“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物質的量濃度為mol/L。
②需要用量筒量取mL上述濃硫酸進行配制。
③為配制上述稀硫酸,除了量筒、燒杯、玻璃棒外,還缺少的玻璃儀器是、。
④在配制過程中,下列實驗操作可能導致配制的硫酸溶液濃度偏高的是(填序號)。
a.定容時俯視觀察
b.定容后經振蕩、搖勻、靜置后,發現液面下降,再加適量的蒸餾水
c.濃硫酸在燒杯中加水稀釋后,未冷卻就向容量瓶中轉移
d.容量瓶未干燥即用來配制溶液
e.往容量瓶轉移時,有少量液體濺出
f.未洗滌稀釋濃硫酸的燒杯組卷:36引用:3難度:0.7 -
18.草酸亞鐵晶體(FeC2O4?2H2O,M=180g/mol)呈淡黃色,可用于曬制藍圖。某實驗小組對其進行了一系列探究。
Ⅰ.純凈草酸亞鐵晶體熱分解產物的探究
(1)氣體產物成分的探究。小組成員采用如圖裝置進行實驗: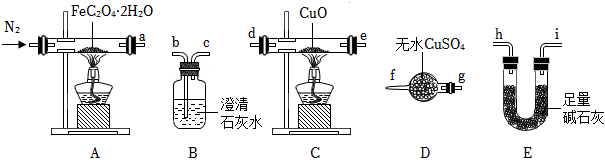
①按照氣流從左到右的方向,上述裝置的接口順序為a→g→f→→尾氣處理裝置(儀器可重復使用)。
②檢查裝置氣密性后,先通入一段時間N2,其目的為。
③實驗證明了氣體產物中含有CO,依據的實驗現象為。
④結束實驗時先熄滅A、C處的酒精燈再停止通入N2,其目的是。
(2)小組成員設計實驗證明了A中分解后的固體成分為FeO,則草酸亞鐵晶體分解的化學方程式為。
(3)曬制藍圖時,草酸亞鐵晶體是感光劑,會失去結晶水轉化為FeC2O4,現以K3[Fe(CN)6]溶液為顯色劑,該顯色反應的化學方程式為。
Ⅱ.草酸亞鐵晶體樣品純度的測定
工業制得的草酸亞鐵晶體中常含有FeSO4雜質,測定其純度的步驟如下:
步驟1:稱取mg草酸亞鐵晶體樣品并溶于稀H2SO4中,配成250mL溶液;
步驟2:取上述溶液25.00mL,用cmol?L-1KMnO4標準液滴定至終點,消耗標準液V1mL;
步驟3:向反應后溶液中加入適量鋅粉,充分反應后,加入適量稀H2SO4,再用cmol?L-1KMnO4標準溶液滴定至終點,消耗標準液V2mL。
(4)步驟2中滴定終點的現象為;步驟3中加入鋅粉的目的為。
(5)若步驟1配制溶液時部分Fe2+被氧化變質,則測定結果將(填“偏高”、“偏低”或“不變”)組卷:19引用:2難度:0.4


