2021-2022學年安徽省合肥八中高二(上)第三次月考化學試卷
發布:2024/4/20 14:35:0
一、(選擇題共54分)
-
1.下列說法或表示方法正確的是( )
A.由C(石墨,s)=C(金剛石,s)ΔH=+1.90kJ?mol-1可知,金剛石比石墨穩定 B.對于2SO2(g)+O2(g)?2SO3(g)ΔH=-QkJ?mol-1 (Q>0),若反應中充入1molSO2和足量的氧氣反應時,放出的熱量為 kJQ2C.HCl與NaOH反應的中和熱ΔH=-57.3kJ?mol-1,若將含1molHCl的稀鹽酸與1molNaOH固體混合,放出的熱量等于57.3kJ D.某化學反應其:ΔH=-122kJ?mol-1,ΔS=231J?mol-1?K-1,則此反應在任何溫度下都能自發進行 組卷:3引用:1難度:0.5 -
2.如圖實驗操作能達到實驗目的的是( )
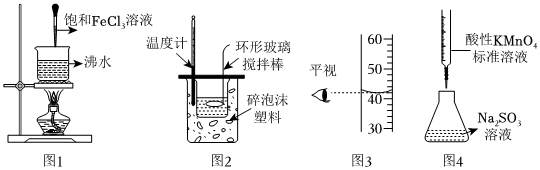
A.圖1可制得氫氧化鐵膠體 B.圖2可用來測定中和反應的反應熱 C.圖3的讀數為42.00mL D.圖4可用標準酸性高錳酸鉀溶液測定未知Na2SO3溶液的濃度 組卷:16引用:5難度:0.5 -
3.研究表明汽車尾氣處理存在反應:N2O(g)+CO(g)═N2(g)+CO2(g),N2O與CO在Fe+作用下發生反應的能量變化及反應歷程如圖所示。下列說法不正確的是( )
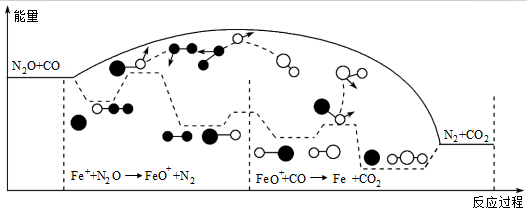
A.升高溫度,該反應的平衡常數減小 B.Fe+不影響該反應的焓變 C.FeO+可以有效提高反應物的平衡轉化率 D.Fe++N2O→FeO++N2,FeO++CO→Fe++CO2兩步反應,前者反應速率慢 組卷:15引用:2難度:0.7 -
4.一定溫度下,將2mol A和2mol B兩種氣體混合放入體積為2L的密閉剛性容器中,發生反應3A(g)+B(g)?xC(g)+2D(g),2min末反應達到平衡,生成0.8mol D,并測得C的物質的量濃度為0.4mol?L-1,下列說法正確的是( )
A.x的值為1 B.A的平衡轉化率為40% C.此溫度下該反應的平衡常數K等于0.5 D.A和B的平衡轉化率相等 組卷:246引用:21難度:0.5 -
5.在一個不傳熱的固定容積的密閉容器中,可逆反應N2(g)+3H2(g)?2NH3(g),達到平衡的標志是( )
①反應速率v(N2):v(H2):v(NH3)=1:3:2;
②各組分的物質的量濃度不再改變;
③體系的平均摩爾質量不變;
④混合氣體的密度不變(相同狀況);
⑤體系的溫度不再發生變化;
⑥2v(N2)(正)=v(NH3)(逆);
⑦單位時間內有3molH-H斷裂同時有2molN-H斷裂。A.①②③⑤⑥⑦ B.②③④⑤⑥ C.②③⑤⑥ D.②③④⑥⑦ 組卷:21引用:2難度:0.7 -
6.為探究CuSO4對H2O2分解是否有催化作用,分別取10mL30%H2O2(約10mol?L-1)于四支試管中,控制其它條件相同,進行實驗獲得如下表數據(氧氣為標準狀況下的體積):
下列有關說法不正確的是( )實驗編號 所加藥品 控制溫度/℃ 生成氧氣體積/(mL) 第1個2min 第2個2min 第3個2min ① 2mL0.51mol?L-1CuSO4 20 4.8 5.7 6.8 ② 30 12.8 16.7 20.2 ③ 40 89.6 63.0 28.0 ④ 2mLH2O 40 2.0 3.2 4.3 A.由以上實驗數據可得Cu2+對H2O2分解一定有催化作用 B.CuSO4對H2O2分解催化效率隨溫度升高而升高 C.實驗③第1個2minH2O2的平均反應速率約為0.8mol?L-1?min-1 D.由實驗④可得H2O2分解為放熱反應 組卷:4引用:1難度:0.7 -
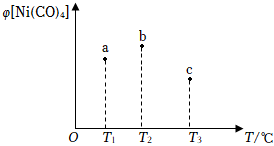 7.在容積均為1L的三個密閉容器中,分別放入鎳粉并充入1mol CO,控制在不同溫度下發生反應:Ni(s)+4CO(g)?Ni(CO)4(g),當反應進行到5min時,測得Ni(CO)4的體積分數與溫度的關系如圖所示。下列說法正確的是( )
7.在容積均為1L的三個密閉容器中,分別放入鎳粉并充入1mol CO,控制在不同溫度下發生反應:Ni(s)+4CO(g)?Ni(CO)4(g),當反應進行到5min時,測得Ni(CO)4的體積分數與溫度的關系如圖所示。下列說法正確的是( )A.正反應為吸熱反應,平衡常數:K(T1)>K(T2) B.反應進行到5min時,b容器中v正(CO)=v逆(CO) C.達到平衡時,a、b、c中CO的轉化率為b>a>c D.減壓或升溫可將b中的平衡狀態轉變成c中的平衡狀態 組卷:25引用:4難度:0.5
二、填空題(本大題共3小題,共46分)
-
20.許多含硫化合物在生產生活中有著重要的應用。
I.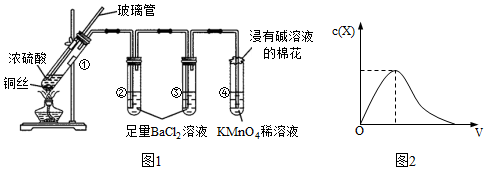
實驗過程中的實驗現象記錄如下表:
(1)結合試管②中現象,試管①中產生的“白霧”的主要成分是試管 ① ② ③ ④ 實驗現象 溶液仍為無色,有白霧、白色固體產生 有大量白色沉淀產生 有少量白色沉淀產生 溶液褪色 (填化學式);為避免“白霧”對后續實驗產生干擾,可在試管①和試管②之間接入一個盛有的洗氣裝置(填序號)。
a.飽和NaHSO3溶液
b.飽和NaHCO3溶液
c.堿石灰
(2)工業上可以用NaOH溶液或氨水吸收SO2,若SO2過量,可分別生成NaHSO3、NH4HSO3,其水溶液均呈酸性。
①相同條件下,同濃度的兩種酸式鹽的水溶液中c()較小的是SO2-3。
②若向NaHSO3溶液中加入少量的I2,則溶液中將c(H2SO3)c(HSO3-)(填“增大”“減小”或“不變”)。
③用NaOH溶液吸收SO2,當吸收液呈中性時,溶液中離子濃度關系正確的是(填字母)。
a.c(Na+)=2c()+c(SO2-3)HSO-3
b.c(Na+)>c(H+)=c(OH-)>c()>c(HSO-3)SO2-3
c.c(Na+)+c(H+)=c()+c(SO2-3)+c(OH-)HSO-3
(3)向NaOH溶液中緩慢通入SO2和HCl的混合氣體至過量,反應過程中某微粒X的物質的量濃度隨通入混合氣體的體積(V)變化如圖2所示。該微粒X為。請寫出X濃度剛剛開始下降的時候的離子方程式。
Ⅱ.氧化還原滴定也是分析化學中常用的分析手段,用氧化還原滴定方法測定粗品中Na2S2O3?5H2O的質量分數。
實驗步驟:
①稱取6g粗品配制250mL溶液待用。
②用酸式滴定管取25.00mL0.01mol?L-1K2Cr2O7溶液于錐形瓶中,然后加入過量的KI溶液并酸化,加幾滴淀粉溶液。
③立即用配制的Na2S2O3溶液滴定至終點(反應為I2+2S2═2I-+S4O2-3),消耗Na2S2O3溶液25.00mL。回答下列問題:O2-6
(4)向K2Cr2O7溶液中加入過量的KI溶液并酸化,Cr2被還原成Cr3+,寫出該反應的離子方程式O2-7。
(5)用Na2S2O3溶液滴定至終點的操作及現象為。
(6)粗品中Na2S2O3?5H2O的質量分數為。組卷:9引用:1難度:0.6 -
21.工業上,用方鉛礦(主要成分為PbS,含有FeS等雜質)和軟錳礦(主要成分為MnO2,含有少量Fe2O3、Al2O3等雜質)制備PbSO4和錳的氧化物。其工藝流程如圖所示。
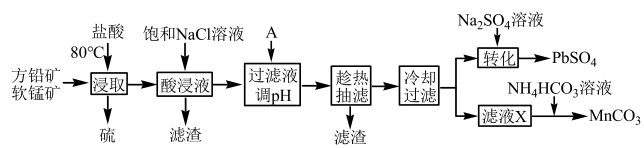
已知:①PbCl2難溶于冷水,易溶于熱水;bCl2(s)+2Cl-(aq)?PbCl42- (aq)ΔH>0。
②部分金屬離子開始沉淀和沉淀完全的pH如下表:
③25℃時,Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=2.5×10-8。金屬離子 Fe2+ Fe3+ Al3+ Mn2+ Pb2+ 開始沉淀的pH 7.0 2.7 3.7 7.6 7.0 沉淀完全的pH 9.6 3.5 4.7 9.8 9.0
回答下列問題:
(1)“浸取”需控制溫度在80℃左右,為加快酸浸速率,還可采用的方法有(任寫一條)。“浸取”過程中發生的主要反應的化學方程式為。
(2)加入飽和NaCl溶液的目的是;物質A調節pH的范圍是;25℃時,PbCl2轉化為PbSO4沉淀反應的平衡常數K=。
(3)濾液X中加入NH4HCO3溶液發生反應的離子方程式為。
(4)將過濾洗滌干燥后得到的MnCO3在空氣中加熱,轉化為不同價態的錳的氧化物,其固體殘留率隨溫度變化如圖所示。圖中D點對應固體的成分為(填化學式)。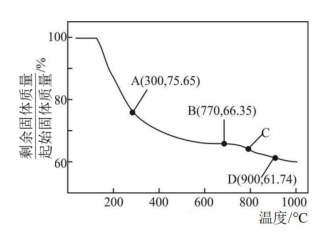 組卷:29引用:2難度:0.3
組卷:29引用:2難度:0.3


