2021-2022學年湖北省部分學校高一(下)聯考化學試卷(3月份)
發布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列生活中的常見物品或設施,其主要成分為硅單質的是( )
A.磚瓦 B.計算機芯片 C.門窗玻璃 D.石英鐘 組卷:18引用:4難度:0.6 -
2.已知稀硝酸可以溶解金屬鋁,其反應為Al+4HNO3═Al(NO3)3+NO↑+2H2O。下列表示該反應中相關微粒的化學用語錯誤的是( )
A.中子數為10的氧原子:18O B.Al3+的結構示意圖: 
C.13N和14N互為同位素 D.H2O的電子式:H:O:H 組卷:28引用:3難度:0.8 -
3.下列物質溶于水沒有化學鍵斷裂的是( )
A.HCl B.NaOH C.Na2O D.乙醇 組卷:19引用:4難度:0.7 -
4.下列關于物質分類的正確組合是( )
堿 酸 鹽 堿性氧化物 酸性氧化物 A 燒堿 HNO3 FeSO4 CaO CO2 B 純堿 HCl NH4Cl MgO P2O5 C 熟石灰 NaHSO4 NaHCO3 CaO SO2 D 氫氧化鐵 CH3COOH CaCO3 K2O CO A.A B.B C.C D.D 組卷:163引用:2難度:0.8 -
5.下列有關氮及其化合物的說法正確的是( )
A.光化學煙霧的形成與氮氧化物有關 B.濃硝酸氧化性強,不能用鐵質或鋁質容器貯運 C.鎂、鋅等活潑金屬可與稀硝酸反應,生成氫氣 D.氮的固定只有在高溫、高壓、催化劑存在的條件下才能實現 組卷:18引用:1難度:0.9 -
6.某兒童在廣州市兒童醫院臨床檢驗結果報告單的部分數據如圖,根據圖中的數據,下列解讀錯誤的是( )
分析項目 檢測結果 單位 參考范圍 1 鋅(Zn) 115.92 μmol?L-1 66~120 2 鐵(Fe) 6.95 mmol?L-1 7.52~11.82 3 鈣(Ca) 1.78 mmol?L-1 1.55~2.60 A.該兒童鐵元素含量偏低,應補充鐵元素 B.報告單中“μmol?L-1”為物質的量濃度的單位,“mmol?L-1”為物質的量的單位 C.從報告單可知,兒童體內鋅的含量低于鐵的含量 D.該兒童體內所含鐵元素的物質的量約為鈣元素物質的量的3.9倍 組卷:24引用:4難度:0.8
二、非選擇題:本題共4小題,共55分。
-
18.氮在自然界中的轉化是一個復雜的過程,氮循環是生態系統物質循環的重要組成部分。
(1)在一定條件 下,NH3可用于脫除氮氧化物的煙氣,其反應原理為4xNH3+6NOx(2x+3)N2+6xH2O。該反應中的還原劑為一定條件(填化學式)。
(2)氨的催化氧化是制備硝酸的重要過程,實驗室按如圖所示裝置進行氨的催化氧化實驗。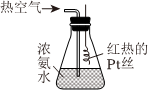
實驗操作:將濃氨水倒入錐形瓶中,從導氣管通入熱空氣,將紅熱的鉑絲伸入錐形瓶中。
實驗現象:a.紅熱的鉑絲始終保持紅熱狀態;b.瓶中有紅棕色氣體生成,瓶內還有白煙生成。
回答下列問題:
①鉑絲始終保持紅熱狀態的可能原因是。
②通入熱空氣的作用是。
③請寫出氨氣的催化氧化反應的化學方程式:。
④紅棕色氣體的化學式為,此氣體可用NaOH溶液吸收,有NaNO2和NaNO3生成,寫出該反應的離子方程式:。
(3)氨是氮循環中的重要物質,在人類的生產和生活中有著廣泛的應用。高濃度的氨氮廢水是造成河流及湖泊富營養化的主要因素,研究表明在微生物作用下,可實現→NH+4的轉化。寫出在堿性條件下,NO-3被氧氣氧化為NH+4的反應的離子方程式:NO-3。每生成1,轉移的電子的物質的量為molNO-3mol。再往含的廢水中加入甲醇,可將NO-3轉化為N2,實現廢水的無害化處理。NO-3組卷:32引用:3難度:0.8 -
19.黃鐵礦(FeS2)是一種重要的含硫礦物,可用于制備硫酸和冶煉金屬鐵。利用黃鐵礦可生產硫酸,其流程如圖所示:

(1)煅燒爐中發生反應的化學方程式為。
(2)爐渣經稀硫酸溶解后,過濾,可得黃色的溶液,若將爐氣通入溶液中,可發現黃色溶液變為淺綠色,而后又變成黃色,其可能的原因為、。(用離子方程式表示)
(3)含有Fe2+、Fe3+的硫酸鹽混合溶液可用于回收硫單質,其轉化關系如圖所示。其中反應①中作氧化劑的是(填離子符號或化學式),該圖示中總反應的化學方程式為。
(4)現將上述爐氣凈化除塵后,得到氣體VL(已換算成標準狀況),將其通入足量H2O2溶液中充分吸收后,再加足量BaCl2溶液充分反應后(不考慮尾氣中其他成分的反應),過濾、洗滌、干燥,得到bg沉淀。H2O2的作用是;凈化除塵后的氣體中SO2含量(體積分數)的計算式是(用含V、b的代數式表示)。組卷:35引用:4難度:0.7


