2021-2022學年北京市清華附中高三(上)調研化學試卷(10月份)
發布:2024/12/31 20:0:3
一、選擇題(1-10每小題2分,11-20每小題2分,共50分)
-
1.下列物質在生活中的應用與氧化還原反應無關的是( )
A.用明礬處理污水 B.還原Fe粉用作食品脫氧劑 C.FeSO4補血劑與維生素C配合使用效果更佳 D.用84消毒液殺滅細菌 組卷:27引用:2難度:0.8 -
2.設NA為阿伏加德羅常數的值.下列說法正確的是( )
A.常溫常壓下,4.4g CO2與N2O混合氣體中含有的原子總數為0.3NA B.常溫常壓下11.2L的甲烷氣體含有的分子數為0.5NA C.1mol?L-1的CuCl2溶液中含有Cl-的數目為2NA D.在過氧化鈉與水的反應中,每生成0.1mol氧氣,轉移電子的數目為0.4NA 組卷:76引用:1難度:0.5 -
3.下列實驗事實和對實驗事實的理論解釋都正確的是( )
選項 實驗事實 理論解釋 A H2S的沸點比H2O的高 H2S的范德華力大于H2O的范德華力 B 白磷為正四面體分子 白磷分子中P-P-P的鍵角是109.5° C 1體積水可以溶解700體積氨氣 氨是極性分子且有氫鍵的影響 D 鍵的極性:H-O>N-H 非金屬性差異越大,鍵的極性越小 A.A B.B C.C D.D 組卷:195引用:5難度:0.7 -
4.氨分子的空間結構是三角錐形,而甲烷是正四面體形,這是因為( )
A.兩種分子的中心原子雜化類型不同,NH3為sp2雜化,而CH4是sp3雜化 B.NH3分子中氮原子形成3個雜化軌道,CH4分子中碳原子形成4個雜化軌道 C.NH3分子中有一對未成鍵的孤電子對,它對成鍵電子的排斥作用較強 D.NH3分子中氮元素的電負性比CH4分子中碳元素的電負性大 組卷:183引用:2難度:0.7 -
5.過氧化鉀與水的反應類似于過氧化鈉與水的反應,其化學方程式為:2K2O2+2H2O=4KOH+O2↑當0.5mol K218O2與足量H2O完全反應后,下表對生成物O2的敘述中錯誤的是( )
K218O2的質量 O2的敘述 A 57g O2的質量為9g B 57g 生成標準情況下O2的體積為5.6L C 114g O2的摩爾質量是32g?mol-1 D 57g 生成0.25molO2 A.A B.B C.C D.D 組卷:12引用:3難度:0.5 -
6.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.FeCl3溶液中,Al3+、Na+、SCN-、SO42- B.鹽酸中:K+、Mg2+、Fe2+、MnO4- C.氨水溶液:Na+、K+、OH-、NO3- D.NaClO溶液中:K+、SO42-、Fe2+、NH4+ 組卷:13引用:2難度:0.7 -
7.下列解釋事實的方程式不正確的是( )
A.向澄清石灰水中滴加少量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O B.用氨水吸收少量的二氧化硫:NH3?H2O+SO2═NH4++HSO3- C.向FeSO4溶液中加入NH4HCO3溶液得到FeCO3沉淀:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O D.在稀硫酸存在下,MnO2將CuS中的硫元素氧化為硫單質:MnO2+CuS+4H+═Mn2++Cu2++S+2H2O 組卷:10引用:2難度:0.6 -
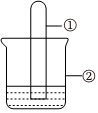 8.用如圖所示裝置進行下列實驗,實驗結果與預測的現象不一致的是( )
8.用如圖所示裝置進行下列實驗,實驗結果與預測的現象不一致的是( )選項 ①中的物質 ②中的物質 預測裝置中現象 A NO2 蒸餾水 試管充滿無色溶液 B SO2 紫色石蕊溶液 溶液逐漸變為紅色 C NH3 AlCl3溶液 產生白色沉淀 D Cl2 AgNO3溶液 產生白色沉淀 A.A B.B C.C D.D 組卷:20引用:4難度:0.7
二、解答題
-
24.某實驗小組同學模擬工業制碘的方法,探究ClO3-和I-的反應規律.實驗操作及現象如表:
(1)取實驗2后的溶液,進行如圖實驗:實驗及試劑 編號 無色NaClO3
溶液用量試管中
溶液顏色淀粉KI
試紙顏色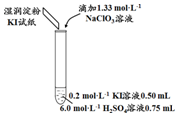
1 0.05 mL 淺黃色 無色 2 0.20 mL 深黃色 無色 3 0.25 mL 淺黃色 藍色 4 0.30 mL 無色 藍色 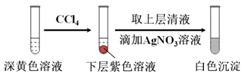
經檢驗,上述白色沉淀是AgCl.寫出加入0.20mL NaClO3后,溶液中ClO3-和I-發生反應的離子方程式:.
(2)查閱資料:一定條件下,I-和I2都可以被氧化成IO3-.
作出假設:NaClO3溶液用量增加導致溶液褪色的原因是過量的NaClO3溶液與(1)
中的反應產物繼續反應,同時生成Cl2.
進行實驗:
①取少量實驗4中的無色溶液進行如圖實驗,進一步佐證其中含有IO3-.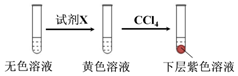
其中試劑X可以是(填字母序號).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同學提出,僅通過濕潤淀粉KI試紙變藍的現象不能說明生成Cl2,便補充了如下實驗:將實驗4中的濕潤淀粉KI試紙替換為濕潤的淀粉試紙,再滴加0.30mL 1.33mol?L-1NaClO3溶液后,發現濕潤的淀粉試紙沒有明顯變化.進行以上對比實驗的目的是,進一步佐證實驗4中生成了Cl2.獲得結論:NaClO3溶液用量增加導致溶液褪色的原因是(用離子方程式表示).
(3)小組同學繼續實驗,通過改變實驗4中硫酸溶液的用量,獲得如表實驗結果:
①對比實驗4和5,可以獲得的結論是編號 6.0 mol?L-1 H2SO4溶液用量 試管中溶液顏色 淀粉KI試紙顏色 5 0.25 mL 淺黃色 無色 6 0.85 mL 無色 藍色 .
②用離子方程式解釋實驗6的現象:.組卷:28引用:3難度:0.3 -
25.鈣鈦礦(CaTiO3) 型化合物是一類可用于生產太陽能電池、傳感器、固體電阻器等的功能材料。回答下列問題:
(1)基態Ti原子的核外電子排布式為。
(2)Ti的四鹵化物熔點如下表所示,TiF4熔點高于其他三種鹵化物,自TiCl4至TiI4熔點依次升高,原因是。
(3)CaTiO3的晶胞如圖(a)所示,其組成元素的電負性大小順序是化合物 TiF4 TiCl4 TiBr4 TiI4 熔點/℃ 377 -24.12 38.3 155 ;金屬離子與氧離子間的作用力為,Ca2+的配位數是。
(4)一種立方鈣鈦礦結構的金屬鹵化物光電材料的組成為Pb2+、I-和有機堿離子CH3,其晶胞如圖(b)所示。其中Pb2+與圖(a)中NH+3的空間位置相同,有機堿CH3中,N原子的雜化軌道類型是NH+3;若晶胞參數為anm,則晶體密度為g?cm-3 (列出計算式)。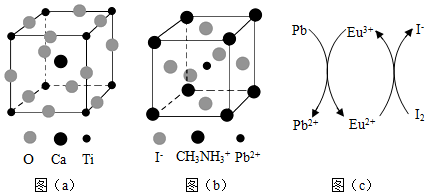
(5)用上述金屬鹵化物光電材料制作的太陽能電池在使用過程中會產生單質鉛和碘,降低了器件效率和使用壽命。我國科學家巧妙地在此材料中引入稀土銪(Eu)鹽,提升了太陽能電池的效率和使用壽命,其作用原理如圖(c)所示,用離子方程式表示該原理、。組卷:174引用:9難度:0.5


