2021-2022學年重慶市巴蜀中學高一(下)期末化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共14小題,每小題3分,共42分.在每小題給出的四個選項中,只有一項是符合題目要求的.
-
1.化學與生產、生活密切相關.下列說法正確的是( )
A.用鋁質容器盛裝濃硫酸,用鐵桶貯存老陳醋 B.金屬、木材、電器等著火均可用二氧化碳滅火 C.為保護環(huán)境,倡導選用一次性筷子、紙杯和塑料袋 D.食鹽和冰醋酸溶于水是物理變化,但是有化學鍵被破壞 組卷:12引用:2難度:0.8 -
2.下列氣體中,既可以用濃H2SO4干燥,又可用堿石灰干燥的是( )
A.SO2 B.NH3 C.O2 D.Cl2 組卷:13引用:3難度:0.8 -
3.對于反應2A(g)+B(g)?2C(g)+3D(g),下列各數據表示不同條件下的反應速率,其中反應進行得最快的是( )
A.v(A)=0.09mol?L-1?s-1 B.v(B)=0.02mol?L-1?s-1 C.v(C)=0.07mol?L-1?s-1 D.v(D)=1.0mol?L-1?min-1 組卷:28引用:2難度:0.5 -
4.下列說法正確的是( )
A.從海帶中提取碘的過程是:灼燒→浸泡→過濾→氧化→萃取→蒸餾 B.海水的“吹出法”提溴過程只涉及物理變化 C.工業(yè)上常用電解熔融氯化鋁法冶煉鋁單質 D.玻璃是將黏土、石灰石、石膏在玻璃熔爐中高溫熔融制得的 組卷:23引用:2難度:0.6 -
5.下列反應的離子方程式正確的是( )
A.海水提鎂中用石灰乳沉鎂:Mg2++2OH-=Mg(OH)2↓ B.向FeI2溶液中加入足量溴水:2Fe2++Br2=2Fe3++2Br- C.將SO2通入氯水溶液中:SO2+Cl2+2H2O=4H++SO42-+2Cl- D.過量鐵粉加入稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O 組卷:24引用:2難度:0.7 -
6.下列關于反應能量的說法正確的是( )
A.由C(石墨)→C(金剛石)ΔH=+1.9kJ?mol-1可知:金剛石比石墨穩(wěn)定 B.相同條件下,H2(g)+ O2(g)=H2O(g)ΔH1;H2(g)+12O2(g)=H2O(l)ΔH2,則ΔH1>ΔH212C.甲烷的燃燒熱為890.3kJ?mol-1,則甲烷燃燒的熱化學方程式可表示為CH4(g)+2O2(g)CO2(g)+2H2O(g)ΔH=-890.3kJ?mol-1 D.已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ?mol-1,則含1molNaOH的氫氧化鈉溶液與含0.5molH2SO4的濃硫酸混合放出57.3kJ的熱量 組卷:27引用:2難度:0.8
二、非選擇題:共58分.
-
17.我國力爭于2030年前做到碳達峰,2060年前實現碳中和.研究和深度開發(fā)CO、CO2的應用具有重要的意義.請回答下列問題:
Ⅰ.CO和H2可合成甲醇,已知:CO(g)+2H2(g)?CH3OH(g) ΔH<0.
(1)恒溫條件下,在體積固定的密閉容器中進行該反應,達到平衡狀態(tài)的標志的是.
A.單位時間內生成nmol CH3OH的同時生成2nmol H2
B.混合氣體的密度不再改變的狀態(tài)
C.混合氣體的壓強不再改變的狀態(tài)
D.混合氣體的平均摩爾質量不再改變的狀態(tài)
E.CO、H2、CH3OH濃度之比為1:2:1的狀態(tài).
(2)下列措施中有利于增大反應的反應速率且利于反應正向進行的是.
a.隨時將CH&3OH與反應混合物分離
b.降低反應溫度
c.增大體系壓強
d.使用高效催化劑
(3)一定條件下向2L的密閉容器中充入1mol CO和2mol H2發(fā)生反應,CO的平衡轉化率與溫度、壓強的關系如圖所示: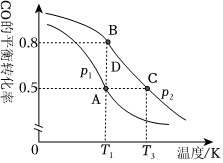
壓強p1p2(“>”“<”或“=”);A、B、C三點平衡常數KA、KB、KC的大小關系是在溫度為T2℃,壓強為P2的條件下達平衡后,再加入0.5mol CO和1mol H2,新平衡下CO的轉化率為.
Ⅱ.CO2可轉化為高附加值碳基燃料,可有效減少碳的排放.已知:
在催化劑作用下CO2甲烷化分兩步完成:
①CO2(g)+H2(g)?CO(g)+H2O(g) Kp1
②CO(g)+H2(g)?O2(g)+12CH4(g) Kp212
總反應③:CO2(g)+2H2(g)?12CH4(g)+H2O(g) Kp212
(4)一定溫度范圍內對上述反應的平衡常數Kp進行計算,得1gKp-的線性關系如圖所示.1T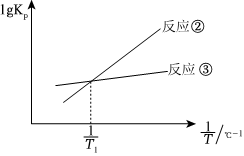
a.T1℃時,Kp1=.
b.反應Ⅰ中,正反應的活化能(填“>”、“<”或“=”)逆反應的活化能.
c.T1℃時,上述體系達到平衡后,若p(CO)=p(H2),將容器的體積若壓縮為原來的一半,平衡的平衡移動方向及理由為.組卷:13引用:2難度:0.6 -
18.研究碳、氮及其化合物氣體的相關反應對治理大氣污染、建設生態(tài)文明具有重要意義.在一定條件下焦炭可以還原NO2,反應為:2NO2(g)+2C(s)?N2(g)+2CO2(g).
(1)已知:一定條件下,由最穩(wěn)定的單質生成1mol純物質的熱效應,稱為該物質的生成焓(ΔH).
則2NO2(g)+2C(s)?N2(g)+2CO2(g) ΔH=物質 NO2(g) CO2(g) 生成焓(ΔH)/kJ?mol-1 +33.2 -393.5 kJ?mol-1
(2)再恒溫恒容的密閉容器中進行該反應,達到平衡狀態(tài)后,若從反應體系中分離出CO2,則在平衡移動過程中.
A.K值減小
B.逆反應速率先減小后增大
C.K值增大
D.正反應速率減小先慢后快
(3)在一定體積的密閉容器中,該反應的化學平衡常數K和溫度t的關系如下:
回答下列問題:t℃ 500 600 700 800 1000 K 2.6 1.9 1.0 0.7 0.4
①某溫度下,平衡濃度符合下式:[]2=c(N2),試判斷此時的溫度為c(NO2)c(CO2)℃.
②800℃時發(fā)生上述反應,某一時刻測得容器內物質的濃度分別為:NO2為4.5mol?L-1,N2為1.5mol?L-1,CO2為3mol?L-1,則此時反應向(填“正反應方向”或“逆反應方向”)進行.
(4)有人利用反應2C(s)+2NO2(g)?N2(g)+2CO2(g)對NO2進行吸附.在T℃下,將n(NO2):n(Ar)=1:9的混合氣體以一定流速通過填充有碳粉的反應器,在不同壓強下,相同時間內NO2的轉化率與壓強的關系如圖所示.
①圖中曲線呈現先升高后降低的變化,其降低的原因是,其升高的原因是.
②在T℃、1100kPa時,已知混合氣體通過反應器的時間為9s,請計算NO2分壓的平均變化率為kPa?s-1(氣體分壓=氣體總壓×體積分數:保留兩位小數).組卷:23引用:2難度:0.6


