2022-2023學年湖南省長沙市瀏陽市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題3分,共30分.在每小題給出的四個選項中,只有一項符合題目要求.
-
1.化學與社會環境、科學技術密切相關。下列有關說法正確的是( )
A.國家速滑館使用的二氧化碳跨臨界直冷制冰利用干冰升華,干冰升華是吸熱反應 B.使用電動汽車和植樹造林有利于實現“碳達峰、碳中和” C.冬奧會火炬“飛揚”使用氫氣燃料,表示氫氣燃燒熱的熱化學方程式為2H2(g)+O2(g)═2H2O(l)ΔH=-572kJ?mol-1 D.我國科學家在國際上首次實現二氧化碳到淀粉的全合成,已知全合成的第一步為吸熱反應,則反應物總能量大于生成物總能量 組卷:5引用:1難度:0.7 -
2.中國學者在水煤氣變換CO(g)+H2O(g)═CO2(g)+H2(g)ΔH中突破了低溫下高轉化率與高反應速率不能兼得的難題,該過程是基于雙功能催化劑(能吸附不同粒子)催化實現的。反應過程示意圖如圖:

下列說法正確的是( )A.過程Ⅰ、過程Ⅲ均為放熱過程 B.過程Ⅱ是吸熱反應 C.使用催化劑降低了水煤氣變換反應的ΔH D.催化劑的重要作用是降低反應的活化能,提高活化分子百分數,從而加快反應速率 組卷:70引用:4難度:0.7 -
3.下列實驗中不能達到預期目的是( )


A.測定反應生成H2的速率 B.探究溫度對反應速率的影響 

C.探究濃度對反應速率的影響 D.探究Fe3+和Cu2+對H2O2分解的催化效果 A.A B.B C.C D.D 組卷:35引用:5難度:0.8 -
4.反應2H2S(g)+CH4(g)?CS2(g)+4H2(g)可用于處理H2S。下列說法正確的是( )
A.上述反應ΔS<0 B.上述反應平衡常數K= c(CS2)?c4(H2)c2(H2S)?c(CH4)C.反應達到平衡后,其他條件不變,向反應容器中通入H2S,再次平衡,H2S轉化率增大 D.其他條件相同,選用高效催化劑,能提高平衡時H2S的轉化率 組卷:12引用:2難度:0.7 -
5.下列事實不能用勒夏特列原理解釋的是( )
A.唾液可以使淀粉水解速率加快 B.工業制取金屬鉀Na(l)+KCl(l)?NaCl(l)+K(g)選取適宜的溫度,使K變成蒸氣從反應混合物中分離出來 C.工業合成氨的過程中使用過量的N2以提高H2的利用率 D.久置氯水顏色變淺,酸性增強 組卷:49引用:3難度:0.6 -
6.有關水的電離平衡,下列敘述一定正確的是( )
A.溫度不變,向水中滴入少量稀鹽酸,平衡逆向移動,Kw減小 B.將水加熱,Kw增大,pH減小,溶液變為酸性 C.溫度不變,向水中加入少量固體NaOH,平衡逆向移動,c(OH-)增大 D.溫度不變,向水中通入HCl,水電離出的氫離子c水(H+)=1.0×10-7mol/L,Kw不變 組卷:59引用:1難度:0.8
三、非選擇題:本題共4小題,共54分.
-
17.已知鋅與稀鹽酸反應放熱,某學生為了探究反應過程中的速率變化,用排水集氣法收集反應放出的氫氣.所用稀鹽酸濃度有1.00mol?L-1、2.00mol?L-1兩種濃度,每次實驗稀鹽酸的用量為25.00mL,鋅有細顆粒與粗顆粒兩種規格,用量為6.50g.實驗溫度為298K、308K.
(1)完成以下實驗設計(填寫表格中空白項),并在實驗目的一欄中填出對應的實驗編號:
(2)實驗①記錄如下(換算成標況):編號 T/K 鋅規格 鹽酸濃度/mol?L-1 實驗目的 ① 298 粗顆粒 2.00 (Ⅰ)實驗①和②探究鹽酸濃度對該反應速率的影響;
(Ⅱ)實驗①和探究溫度對該反應速率的影響;
(Ⅲ)實驗①和實驗④探究鋅規格(粗、細)對該反應速率的影響.② 298 粗顆粒 1.00 ③ 308 粗顆粒 2.00 ④ 298 細顆粒 2.00
①計算在30~40s范圍內鹽酸的平均反應速率v(HCl)=時間(s) 10 20 30 40 50 60 70 80 90 100 氫氣體積(mL) 16.8 39.2 67.2 224 420 492.8 520.8 543.2 554.4 560 (忽略溶液體積變化).
②反應速率最大的時間段(如0s~10s)為,可能原因是.
(3)另一學生也做同樣的實驗,由于反應太快,測量氫氣的體積時不好控制,事先在鹽酸溶液中分別加入等體積的下列溶液以減慢反應速率,在不影響產生氣體總量的情況下,你認為他選擇的溶液可以是(填相應字母).
A.NaNO3溶液
B.NaCl溶液
C.CuSO4溶液
D.Na2CO3
(4)某化學研究小組的同學為比較Fe3+和Cu2+對H2O2分解的催化效果,設計了圖所示的實驗.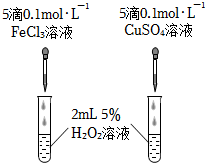
①如圖可通過觀察現象,比較得出比較Fe3+和Cu2+對H2O2分解的催化效果結論.
②該實驗存在明顯不合理的地方,你認為不合理的地方是.組卷:31引用:1難度:0.6 -
18.過渡金屬催化的反應已成為重要的合成工具,貴金屬成本高,會對環境造成不利影響,因此研究成本低廉的含錳、鐵、鈷、鎳、銅等催化劑成為熱點.以下是以含鈷廢渣(主要成分CoO、Co2O3,還含有Al2O3、ZnO等雜質)為原料制備CoCO3的一種工藝流程:

已知:Ksp[CoCO3]=1.4×10-13,Ksp[Co(OH)2]=2.0×10-15.
回答下列問題:
(1)為了加快“酸浸”速率,可以采取的操作有.(至少答兩條)
(2)酸浸時通入SO2的主要作用是.
(3)“除鋁”步驟中,鋁離子發生的離子反應方程式.
(4)“沉鈷”的離子方程式是.
“沉鈷”步驟選擇NaHCO3,而不選擇Na2CO3是為了避免有Co(OH)2的生成,向溶液加入Na2CO3溶液,當溶液的pH達到8時,就會同時有Co(OH)2生成,計算當溶液的pH為8時,溶液中的濃度=CO2-3mol/L.
(5)CoCO3與純堿反應可以制備重要的電極材料鈷酸鋰(LiCoO2).一種充電電池的裝置如圖所示,充放電過程中,存在LiCoO2與Li1-xCoO2之間的轉化,放電過程中Li+從A電極向B電極遷移,寫出該電池放電時的正極反應:,若用該電池進行電解食鹽水,當通過隔膜的離子數目為0.2NA時,電解池陰極收集到的氣體體積在標準狀況下為L. 組卷:19引用:1難度:0.6
組卷:19引用:1難度:0.6


