2022-2023學年寧夏銀川一中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題2分共50分)
-
1.下列反應中,屬于水解反應且使溶液顯酸性的是( )
A.NH3+H2O?NH4++OH- B.HCO3-+H2O?CO32-+H3O+ C.S2-+H2O?HS-+OH- D.NH4++H2O?NH3?H2O+H+ 組卷:108引用:8難度:0.7 -
2.NA是阿伏加德羅常數的值,下列說法正確的是( )
A.0.1mol/LNH4NO3溶液中含有NH4+數小于0.1NA B.1L0.1mol/L氨水中含有的OH-數目為0.1NA C.含NA個CO32-的Na2CO3溶液中,Na+數目大于2NA D.一定條件下,將1molN2與3molH2充入一密閉容器內充分反應后容器內氣體分子數小于2NA 組卷:6引用:1難度:0.8 -
3.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.透明的溶液中:K+、Na+、SO42-、MnO4- B.能使甲基橙變紅的溶液中:Fe2+、K+、NO3-、SO42- C. =10-12的溶液中:NH4+、Ba2+、Cl-、NO3-c(H+)c(OH-)D.由水電離的c(OH-)=1×10-10mol?L-1的溶液中:K+、Na+、NO3-、Al3+ 組卷:3引用:2難度:0.7 -
4.下列說法不正確的是( )
A.測得0.1 mol?L-1的一元酸HA溶液pH=3.0,則HA一定為弱電解質 B.25℃時,將0.1 mol?L-1的NaOH溶液加水稀釋100倍,所得溶液的pH=11.0 C.25℃時,將0.1 mol?L-1的HA溶液加水稀釋至pH=4.0,所得溶液c(OH-)=1×10-10 mol?L-1 D.0.1 mol?L-1的HA溶液與0.1 mol?L-1的NaOH溶液等體積混合,所得溶液pH一定等于7.0 組卷:664引用:13難度:0.7 -
5.從植物花汁中提取的一種有機物,可簡化表示為HIn,在水溶液中因存在下列電離平衡,故可用作酸、堿指示劑:HIn(紅色)?H++In-(黃色)。在上述溶液中加入適量下列物質,最終能使指示劑顯黃色的是( )
A.鹽酸 B.NaHCO3溶液 C.NaHSO4溶液 D.NaClO(固體) 組卷:20引用:6難度:0.8 -
6.灰錫(以粉末狀存在)和白錫是錫的兩種同素異形體.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)Sn(s,白)△H3=+2.1kJ?mol-1,>13.2℃<13.2℃
下列說法正確的是( )A.△H1>△H2 B.錫在常溫下以灰錫狀態存在 C.灰錫轉為白錫的反應是放熱反應 D.錫制器皿長期處在低于13.2℃的環境中,會自行毀壞 組卷:226引用:55難度:0.7 -
7.在固定容積的密閉容器中,A和B發生下列反應:A(s)+2B(g)?2C(g)ΔH>0,在一定條件下達到平衡,若升高溫度則達平衡后混合氣體的( )
A.氣體的分子數減少 B.A的物質的量濃度減小 C.氣體的密度減小 D.氣體的平均相對分子質量增大 組卷:93引用:3難度:0.8 -
8.恒溫密閉容器中加入一定量的A,發生反應A(s)?B+C(g)-QkJ(Q>0),達到平衡。以下分析正確的是( )
A.加入少量B,平衡就會逆向移動 B.達到平衡的標志之一:v(B)生成=(C)生成 C.若開始時向容器中加入1mol A,達到平衡時吸收熱量QkJ D.縮小容器體積,重新達到平衡時,C(g)的濃度與原平衡濃度相等 組卷:70引用:2難度:0.5 -
9.化學反應進行的方向是一個比較復雜的問題。下列有關說法正確的是( )
A.反應SO3(g)+H2O(1)═H2SO4(1)的ΔS>0 B.1molCO2在不同狀態時的熵值:S[CO2(g)]<S[CO2(s)] C.反應2N2O5(g)═4NO2(g)+O2(g) ΔH>0能否自發進行與溫度有關 D.ΔH<0或ΔS>0的反應一定能自發進行 組卷:25引用:8難度:0.5
二、填空題(每空2分,共50分)
-
28.現有濃度均為0.1mol?L-1的下列溶液:①硫酸 ②醋酸 ③氫氧化鈉 ④氯化銨;請回答下列問題:
(1)四種溶液中由水電離出的H+濃度由大到小的順序是(填序號)。
(2)將③和④等體積混合后,混合液中各離子濃度由大到小的順序是。
(3)已知T℃,Kw=1×10-13,則T℃25℃(填“>”、“<”或“=”)。在T℃時將pH=11的NaOH溶液aL與pH=1的硫酸bL混合(忽略混合后溶液體積的變化),若所得混合溶液的pH=10,則a:b=。
(4)25℃時,有pH=x的鹽酸和pH=y的氫氧化鈉溶液(x≤6,y≥8),取aL該鹽酸與bL該氫氧化鈉溶液反應,恰好完全中和,兩溶液的pH(x、y)的關系式為(填表達式)。
(5)常溫下,將濃度均為0.1mol/L的醋酸溶液和氫氧化鈉溶液混合后,若溶液的pH=7,則c(Na+)c(CH3COO-)(填“>”、“<”或“=”)。組卷:72引用:2難度:0.5 -
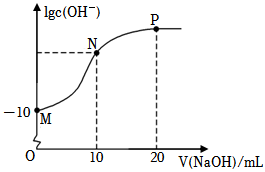 29.回答下列問題:
29.回答下列問題:
(1)常溫下,向20mL0.010mol?L-1的HA溶液中逐滴加入0.010mol?L-1的NaOH溶液,溶液中lgc(OH-)與所加NaOH溶液的體積(V)的關系如圖。HA是(“強酸”或“弱酸”)。N點溶液中2c(H+)-2c(OH-)=(用含A微粒的符號表示)
(2)次氯酸為一元弱酸,具有漂白和殺菌作用,其電離平衡體系中各成分的組成分數δ(X)=,X為HClO或ClO-與pH的關系如圖所示。HClO的電離常數Ka值為c(X)c(HClO)+c(ClO-)。常溫下向0.1mol?L-1的HClO溶液中加入等體積的0.1mol?L-1的NaOH溶液后,c(ClO-)+c(HClO)=mol?L-1。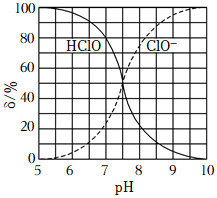
(3)pH相同、等體積的兩份溶液A(鹽酸)和B(CH3COOH)分別與鋅粉反應,若最后僅有一份溶液中存在鋅,放出氫氣的質量相同,則下列說法正確的是(填序號)。
①反應所需要的時間B>A
②開始反應時的速率A>B
③參加反應的鋅的物質的量A=B
④反應過程的平均速率B>A
⑤A中有鋅剩余
⑥B中有鋅剩余
(4)已知草酸為二元弱酸:H2C2O4?HC2O4-+H+ Ka1,HC2O4-?C2O42-+H+ Ka2,常溫下,向某濃度的H2C2O4溶液中逐滴加入一定濃度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三種微粒的物質的量分數(δ)與溶液pH的關系如圖所示。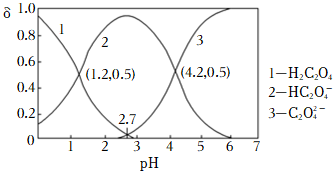
①則常溫下0.1mol/L的NaHC2O4溶液顯(填酸性、堿性或中性)。
②pH=2.7時,溶液中=c2(HC2O4-)c(H2C2O4)?c(C2O42-)。組卷:46引用:3難度:0.5


