2021年北京市海淀區高考化學模擬試卷
發布:2024/4/20 14:35:0
一、單選題(本題包括15個小題,每小題4分,共60分.每小題只有一個選項符合題意)
-
1.下列生活用品的主要成分不屬于有機高分子物質的是( )
A.植物油 B.絲織品 C.聚乙烯 D.人造毛 組卷:95引用:2難度:0.9 -
2.由下列實驗及現象不能推出相應結論的是( )
實驗 現象 結論 A 某鉀鹽晶體中滴加濃鹽酸,產生的氣體通入品紅溶液中 品紅溶液褪色 產生的氣體一定是SO2 B 向裝有經過硫酸處理的CrO3(桔紅色)的導管中吹入乙醇蒸氣 固體逐漸由桔紅色變為淺綠色(Cr3+) 乙醇具有還原性 C 向2mL 0.1mol/LFeCl3溶液中加入銅粉,充分振蕩,再加入2滴KSCN溶液 銅粉溶解,溶液由黃色變為綠色,滴入KSCN溶液顏色不變 氧化性:Fe3+>Cu2+ D 向盛有CuO的試管中加入足量HI溶液,充分振蕩后滴入3滴淀粉溶液 固體有黑色變為白色,溶液變為黃色,滴入淀粉后溶液變藍 CuO與HI發生了氧化還原反應 A.A B.B C.C D.D 組卷:109引用:2難度:0.5 -
3.短周期主族元素W、X、Y、Z的原子序數依次增大,其中兩種元素形成的化合物可用于呼吸面具中作為供氧劑。W、X、Y三種元素形成的一種化合物常用于清洗廚房用具的油污,Z的最外層電子數為X、Y的最外層電子數之和。下列說法不正確的是( )
A.X、Z的某些單質或兩元素之間形成的某些化合物可作水的消毒劑 B.化合物Y2X2和YZX都既存在離子鍵,又存在共價鍵 C.原子半徑大小:W>X;簡單離子半徑:Y<Z D.W與X能形成多種化合物,都能與Y的最高價氧化物的水化物溶液發生反應 組卷:51引用:2難度:0.5 -
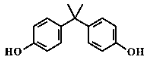 4.雙酚A是重要的有機化工原料,其結構如圖所示。下列關于雙酚A的說法正確的是( )
4.雙酚A是重要的有機化工原料,其結構如圖所示。下列關于雙酚A的說法正確的是( )A.雙酚A的分子式為C15H14O2 B.一定條件下能發生取代和水解反應 C.最多有13個碳原子在同一平面 D.苯環上的二氯代物有4種 組卷:83引用:2難度:0.5 -
5.a、b、c、d為短周期元素,a的M電子層有1個電子,b的最外層電子數為內層電子數的2倍。c的最高化合價為最低化合價絕對值的3倍,c與d同周期,d的原子半徑小于c。下列敘述正確的是( )
A.離子半徑:a>d>c B.a、c形成的化合物中只有離子鍵 C.簡單離子還原性:c<d D.c的單質易溶于b、c形成的二元化合物中 組卷:56引用:3難度:0.5 -
6.在復雜的體系中,確認化學反應先后順序有利于解決問題,下列化學反應先后順序判斷正確的是( )
A.在含等物質的量的AlO2-、OH-、CO32-的溶液中,逐滴加入鹽酸:AlO2-、OH-、CO32- B.在含等物質的量的FeBr2、FeI2的溶液中,緩慢通入氯氣:I-、Br-、Fe2+ C.在含等物質的量的Ba(OH)2、KOH的溶液中,緩慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 D.在含等物質的量的Fe3+、Cu2+、H+的溶液中加入鋅粉:Fe3+、Cu2+、H+、Fe2+ 組卷:219引用:34難度:0.7
四、綜合題(本題包括2個小題,共20分)
-
 18.氮的化合物是重要的工業原料,也是主要的大氣污染來源,研究氮的化合物的反應具有重要意義。回答下列問題:
18.氮的化合物是重要的工業原料,也是主要的大氣污染來源,研究氮的化合物的反應具有重要意義。回答下列問題:
(1)肼(N2H4)與四氧化二氮分別是火箭發射器中最常用的燃料與氧化劑。已知3.2g液態肼與足量液態四氧化二氮完全反應,生成氮氣和液態水放出熱量61.25kJ,則該反應的熱化學方程式為。
(2)尾氣中的NO2可以用燒堿溶液吸收的方法來處理,其中能生成NaNO2等物質,該反應的離子方程式為。
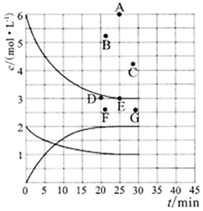
(3)在773K時,分別將2.00 mol N2和6.00 mol H2充入一個固定容積為1 L的密閉容器中發生反應生成NH3,氣體混合物中c(N2)、c(H2)、c(NH3)與反應時間(t)的關系如圖所示。
①下列能說明反應達到平衡狀態的是(選填字母)。
a.v正(N2)=3v逆(H2) b.體系壓強不變
c.氣體平均相對分子質量不變 d.氣體密度不變
②在此溫度下,若起始充入4.00mol N2和12.00mol H2,則反應剛達到平衡時,表示 c(H2)~t的曲線上相應的點為(選填字母)。
(4)在373 K時,向體積為2L的恒容真空容器中充入0.40mol NO2,發生如下反應:
2NO2(g)?N2O4(g)△H=-56.9kJ?mol-1
2NO2?N2O4△H=-56.9kJ?mol-1
測得NO2的體積分數[φ(NO2)]與反應時間(t)的關系如表:
①計算0~20min時,v(N2O4)=t/min 0 20 40 60 80 φ(NO2) 1.0 0.75 0.52 0.40 0.40 。
②已知該反應v正(NO2)=k1?c2(NO2),v逆(N2O4)=k2?c(N2O4),其中k1、k2為速率常數,則373K時,=k1k2;改變溫度至T1時,k1=k2,則T1373K(填“>”“<”或“=”)。組卷:89引用:3難度:0.5 -
19.氮的化合物能影響植物的生長,其氧化物也是大氣的主要污染物之一。
(1)固氮直接影響作物生長。自然固氮發生的反應有:
①N2(g)+O2(g)═2NO(g)△H1=+180.5 kJ?mol-1
②2NO(g)+O2(g)═2NO2(g)△H2=-114.1 kJ?mol-1
③N2(g)+2O2(g)═2NO2(g)△H3=kJ?mol-1。
(2)一定溫度下,將等物質的量的NO和CO通入固定容積為4L的密閉容器中發生反應2NO(g)+2CO(g)?N2 (g)+2CO2 (g),反應過程中CO的物質的量變化如圖甲所示: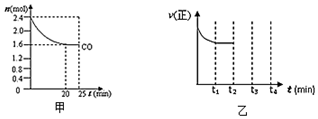
①能判斷反應已達到化學平衡狀態的是(填序號)
A.容器中的壓強不變
B.2v正(CO)=v逆(N2)
C.氣體的平均相對分子質量保持不變
D.NO和CO的體積比保持不變
②0~20min平均反應速率v(NO)為mol/(L?min)。
③反應達平衡后再向容器中加入0.4molCO和0.4molCO2,則此時平衡“向正反應方向移動”、“向逆反應方向移動”或“不移動”)。
④該反應的正反應速率如圖乙所示。在t2時刻,將容器的容積迅速擴大到原來的2倍,在其他條件不變的情況下,t3時刻達到新的平衡狀態。請在圖乙中,補充畫出從t2到t4時刻正反應速率隨時間的變化曲線。
(3)三聚氰酸[C3N3(OH)3]可用于消除汽車尾氣中的NO2,其反應分兩步進行。第一步是:C3N3(OH)33HCNO;第二步是HCNO與NO2反應,把氮元素和碳元素轉變成無毒氣體。請寫出第二步發生的化學反應方程式△。
(4)常溫下,在x mol?L-1氨水中加入等體積的 y mol?L-1硫酸得混合溶液M恰好顯中性。
①M溶液中所有離子濃度由大到小的順序為
②常溫下,NH3?H2O的電離常數K=用含x和y的代數式表示,忽略溶液混合前后的體積變化)。組卷:78引用:2難度:0.4


