2021-2022學年江蘇省揚州市高一(下)期末化學試卷
發布:2024/4/20 14:35:0
選擇題(共42分)單項選擇題(本題包括14小題,每題3分,共42分。每小題只有一個選項符合題意)
-
1.現代社會的發展與進步離不開材料,下列說法不正確的是( )
A.“遼寧艦”上用于艦載機降落的阻攔索是一種特種鋼纜,屬于合金材料 B.“超輕海綿”使用的石墨烯是有機高分子材料 C.速滑館“冰絲帶”使用二氧化碳跨臨界制冰,二氧化碳由分子構成 D.“中國天眼”FAST使用碳化硅,碳化硅是無機非金屬材料 組卷:16引用:1難度:0.7 -
2.氯化氫通入氨水中發生反應:NH3?H2O+HCl═NH4Cl+H2O。下列說法正確的是( )
A.HCl的電子式 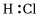
B.中子數為8的氮原子 N87C.氯離子的結構示意圖 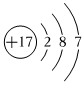
D.反應類型:復分解反應 組卷:15引用:1難度:0.7 -
3.下列物質屬于共價化合物的是( )
A.NH3 B.NH4Cl C.Cl2 D.KOH 組卷:54引用:1難度:0.7 -
4.下列關于乙烯的說法正確的是( )
A.分子中存在碳碳雙鍵 B.分子中C、H元素的質量比為1:2 C.可用向上排空氣法收集 D.不能使酸性KMnO4溶液褪色 組卷:77引用:1難度:0.6 -
5.FeCl3溶液和KI溶液發生反應:2Fe3++2I-?2Fe2++I2。下列關于該反應的說法正確的是( )
A.升高溫度能減慢反應速率 B.增大Fe3+和I-的濃度能加快反應速率 C.反應達到平衡時,溶液中c(Fe3+)與c(Fe2+)相等 D.加入過量FeCl3溶液可使I-的轉化率為100% 組卷:47引用:1難度:0.7
二、非選擇題(共58分)
-
17.
 以FeSO4溶液為主要原料制取廢水處理劑FeOOH,其流程如圖:
以FeSO4溶液為主要原料制取廢水處理劑FeOOH,其流程如圖: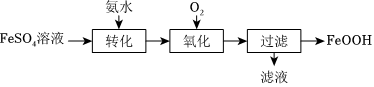
(1)檢驗FeSO4溶液是否被氧化可選用的試劑是(填化學式)。“轉化”時適量氨水將Fe2+部分轉化為Fe(OH)2,每生成1molFe(OH)2,理論上參加該反應的NH3?H2O的物質的量為mol。
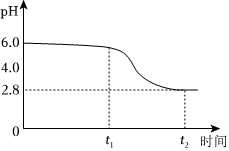
(2)“氧化”時以一定流速向所得固液混合物中通入O2,反應生成FeOOH。過程中溶液的pH隨時間的變化情況如圖所示。
已知:pH=-lgc(H+)。
①0~t1時,Fe(OH)2轉化為FeOOH時發生反應的化學方程式為。
②t1~t2時,FeOOH繼續增加,溶液pH減小,原因是(用離子方程式表示)。
(3)通過下列方法測定產品中FeOOH的質量分數:準確稱取2.000g產品,加適量鹽酸溶解,再加入適量SnCl2溶液,發生反應2Fe3++Sn2+═2Fe2++Sn4+;除去過量的SnCl2,再向其中加入0.1000mol?L-1K2Cr2O7溶液至反應恰好完全,發生反應Cr2+6Fe2++14H+═2Cr3++6Fe3++7H2O,消耗K2Cr2O7溶液36.00mL。計算該產品中FeOOH的質量分數O2-7(寫出計算過程)。組卷:38引用:1難度:0.5 -
18.氮的化合物是重要的化工原料,其轉化一直是化學研究的熱點。
(1)氨催化氧化法是制硝酸的重要步驟,探究氨催化氧化反應的裝置如圖1所示: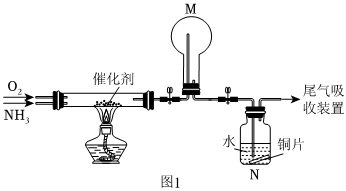
①氨催化氧化時會生成副產物N2O。生成含等物質的量氮元素的NO與N2O時,消耗的O2的物質的量之比為。
②一段時間后,觀察到裝置M中有白煙生成,該白煙成分是(寫化學式)。
③再經過一段時間觀察到裝置N中溶液變成藍色,裝置N中溶液變成藍色的原因是。
(2)可用ClO2將氮氧化物轉化成。向1L含200mgClO2的溶液中加入NaOH溶液調節至堿性,ClO2轉化為去除氮氧化物效果更好的NaClO2,再通入NO氣體進行反應。堿性條件下NaClO2去除NO反應的離子方程式為NO-3。
(3)納米鐵粉可去除水中的。控制其他條件不變,用納米鐵粉還原水體中的NO-3,測得溶液中含氮物質(NO-3、NO-3、NO-2)濃度隨時間變化如圖2所示:NH+4
①Fe去除水中的的機理:NO-3得到納米鐵粉失去的電子轉化為NO-3,極少量NO在納米鐵粉或Cu表面得到電子轉化為NO-2。與不添加少量銅粉相比,添加少量銅粉時去除NH+4效率更高,主要原因是NO-3。
②與初始溶液中濃度相比,反應后溶液中所有含氮物質(NO-3、NO-3、NO-2)總濃度減小,原因是NH+4。組卷:55引用:1難度:0.6


